Lấy cùng một khối lượng kẽm và nhôm cho vào dd H2SO4 loãng, dư. Kim loại nào cho nhiều khí hiđro hơn? Vì sao?

Những câu hỏi liên quan
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng. a) Viết các phương trình phản ứng. b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất? c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
Đọc tiếp
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình phản ứng.
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất?
c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 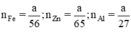
Theo pt nH2 (1) = nZn = 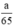 mol
mol
nH2 (2) = nFe = 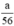 mol
mol
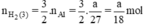
Như vậy ta nhận thấy 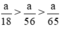 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.
Đúng 1
Bình luận (0)
Baì 6: Trong PTN có thể điều chế khí hiđro bằng cách cho các kim loại : Sắt, Kẽm , Nhôm phản ứng với dd axit Clohidric. a-Nếu lấy cùng một khối lượng mỗi kim loại trên thì khí hiđro điều chế được với kim loaị nào là nhiều nhất.? b-Nếu muốn điều chế cùng một lượng khí hiđro thì dùng kim loại nào tiết kiệm kim loại nhất?
Fe + 2HCl → FeCl2 + H2
Zn + 2HCl → ZnCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
a) Đặt khối lượng của ba kim loại là 1 gam
→ nFe = 1/56 mol, nZn = 1/65 mol, nAl = 1/27 mol
→ Số mol H2 do sắt tạo thành: nH2 (1) = 1/56 mol
Số mol H2 do kẽm tạo thành: nH2 (2) = 1/65 mol
Số mol H2 do nhôm tạo thành: nH2 (3) = 1/18 mol
→ Số mol H2 (2) < (1) < (3)
→ Nếu lấy cùng khối lượng mỗi kim loại trên thì nhôm có thể tạo ra nhiều khí nhất.
b) Đặt số mol khí H2 tạo thành là 1 mol
→ nFe = 1 mol → m Fe = 56 gam
nZn = 1 mol → mZn = 65 gam
nAl = 2/3 mol → mAl = 18 gam
→ Để tạo thành được 1 mol khí H2 thì dùng Al sẽ tốn ít kim loại nhất
Đúng 0
Bình luận (0)
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng. a) Viết các phương trình phản ứng b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hiđro nhất ?c) Nếu thu được cùng một thể tích khí Hiđro thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất ?
Đọc tiếp
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình phản ứng
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hiđro nhất ?
c) Nếu thu được cùng một thể tích khí Hiđro thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất ?
a)
\(Zn+H2SO4\rightarrow ZnSO4+H2\)
\(2Al+3H2SO4\rightarrow Al2\left(SO4\right)3+3H2\)
\(Fe+H2SO4\rightarrow FeSO4+H2\)
b) giải sử khối KL cùng là \(m\left(g\right)\)
\(\Rightarrow n_{Zn}=\frac{m}{65}\Rightarrow n_{H_2}=\frac{m}{65}\)
\(\Rightarrow n_{Al}=\frac{m}{27}\Rightarrow n_{H_2}=1,5.\frac{m}{27}\)
\(\Rightarrow n_{Fe}=\frac{m}{56}\Rightarrow n_{H_2}=\frac{m}{56}\)
\(\Rightarrow Al\)
c) Giả sử : \(n_{H_2}=0,15mol\)
\(\Rightarrow n_{Zn}=0,15mol\Rightarrow m=9,75g\)
\(\Rightarrow n_{Al}=0,1mol\Rightarrow m=2,7g\)
\(\Rightarrow n_{Fe}=0,15mol\Rightarrow m=8,4g\)
\(\Rightarrow Al\)
Đúng 1
Bình luận (0)
Cho 5,4 gam nhôm tác dụng với a gam dung dịch HCl 20%. a) tính thể tích khí H2 thu được? b) tính a? c) với cùng 1 khối lượng như nhau thì giữa nhôm và kẽm kim loại nào cho nhiều khí hiđro hơn?
a, \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 6HCl ---> 2AlCl3 + 3H2
0,2--->0,6------------------->0,3
=> VH2 = 0,3.22,4 = 6,72 (l)
b, \(m_{ddHCl}=\dfrac{0,6.36,5}{20\%}=109,5\left(g\right)\)
c, Đặt mAl = mZn = a (g)
=> \(\left\{{}\begin{matrix}n_{Al}=\dfrac{a}{27}\left(mol\right)\\n_{Zn}=\dfrac{a}{65}\left(mol\right)\end{matrix}\right.\)
PTHH:
2Al + 6HCl ---> 2AlCl3 + 3H2
\(\dfrac{a}{27}\)--------------------------->\(\dfrac{a}{18}\)
Zn + 2HCl ---> ZnCl2 + H2
\(\dfrac{a}{65}\)-------------------------->\(\dfrac{a}{65}\)
So sánh: \(\dfrac{a}{18}< \dfrac{a}{65}\)=> Al cho nhiều H2 hơn
Đúng 2
Bình luận (1)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ pthh:2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,6 0,3
=> \(V_{H_2}=0,3.22,4=6,72\left(l\right)\\ m_{HCl}=20\%.0,6.36,5=4,38\left(g\right)\)
gọi nAl = nZn = a
\(pthh:2Al+6HCl\rightarrow2AlCl_3+3H_2\) (1)
a \(\dfrac{3}{2}a\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\) (2)
a a
=> \(m_{H_2}\left(1\right)=\dfrac{3}{2}a.2=3a\left(g\right)\\ m_{H_2}\left(2\right)=a.2=2a\left(G\right)\)
=> Al sản xuất ra nhiều H2 hơn
Đúng 0
Bình luận (0)
Lấy cùng một khối lượng ban đầu các kim loại Mg,Al,Zn,Fe cho tác dụng với dung dịch H2SO4 loãng dư. Kim loại nào giải phóng lượng khí H2 nhiều nhất ở cùng điều kiện ?
A. Mg
B. Zn
C. Fe
D. Al
Đáp án : D
Khi phản ứng với H+
1 mol Al -> 1,5 mol H2
1 mol (Zn,Mg,Fe) -> 1 mol H2
Đúng 0
Bình luận (0)
Câu 10. Lấy cùng một khối lượng mỗi kim loại kẽm, nhôm, magie, sắt lần lượt tác dụng hết với dung dịch axit sunfuric loãng, dư. Phản ứng tạo ra nhiều hiđro nhất là của A. sắt. B. kẽm. C. magie. D. nhôm
làm chi tiết rồi mới chọn đáp án nha
Hoà tan 7,5 g hỗn hợp gồm Cu và Al vào dd H2SO4 loãng , dư đc 3,36 lít khí á.Tính % theo khối lượng mỗi kim loại trong hỗn hợp b, Nếu cho cùng lượng hỗn hợp kim loại trên vào dd H2SO4 đặc nóng dư. Tính thể tích khí SO2( là sản phẩm khử duy nhất ) thu đc .
a) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,1<----------------------------0,15
=> \(\%m_{Al}=\dfrac{0,1.27}{7,5}.100\%=36\%\)
\(\%m_{Cu}=100\%-36\%=64\%\)
b) \(n_{Cu}=\dfrac{7,5-0,1.27}{64}=0,075\left(mol\right)\)
PTHH: Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,075------------------------>0,075
2Al + 6H2SO4 --> Al2(SO4)3 + 3SO2 + 6H2O
0,1----------------------------->0,15
=> VSO2 = (0,075 + 0,15).22,4 = 5,04 (l)
Đúng 2
Bình luận (0)
Cho 15,75g hỗn hợp 2 kim loại Cu và Zn vào dd H2SO4 loãng dư, thu được 33,61 khí (đktc).a) Tinh khối lượng mỗi kim loại trong hỗn hợp đầu.b) Tinh khối lượng dd muối thu được.Bài 8: Cho a gam hỗn hợp Fe, Cu có khối lượng bằng nhau vào dd H2SO4 loãng dư thu được 2,24 lít H2(đktc). Chất rắn không tan đem hoà tan hết trong dd H2SO4 đặc nóng thu được V lít SO2.Tính V b)Ngâm a gam hỗn hợp trên vào dd CuSO4 dư, tính khối lượng chất rắn thu được sau pưBài 9: Cho 8,4g bột Fe vào 100ml dd 1M( D1,08g/ml)...
Đọc tiếp
Cho 15,75g hỗn hợp 2 kim loại Cu và Zn vào dd H2SO4 loãng dư, thu được 33,61 khí (đktc).
a) Tinh khối lượng mỗi kim loại trong hỗn hợp đầu.
b) Tinh khối lượng dd muối thu được.
Bài 8: Cho a gam hỗn hợp Fe, Cu có khối lượng bằng nhau vào dd H2SO4 loãng dư thu được 2,24 lít H2(đktc). Chất rắn không tan đem hoà tan hết trong dd H2SO4 đặc nóng thu được V lít SO2.Tính V b)Ngâm a gam hỗn hợp trên vào dd CuSO4 dư, tính khối lượng chất rắn thu được sau pư
Bài 9: Cho 8,4g bột Fe vào 100ml dd 1M( D=1,08g/ml)đến khi pư kết thúc thu được chất rắn X và dd Y. Hoà tan X trong dd HCl dư thấy còn lại a gam chất rắn không tan. a) Viết PTHH b) Tính a và C% chất tan trong dd Y
Bài 2: Cho 12,1g hỗn hợp hai kim loại sắt và kẽm vào dd H2SO4 loãng dư sau phản ứng sinh ra 2,24 lit khí (đktc). Tính thành phần trăm theo khối lượng của hỗn hợp đầu?
Gọi x, y lần lượt là số mol của Fe và Zn
\(PTHH:\)
\(Fe+H_2SO_4--->FeSO_4+H_2\uparrow\left(1\right)\)
\(Zn+H_2SO_4--->ZnSO_4+H_2\uparrow\left(2\right)\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo đề, ta có: \(56x+65y=12,1\)(*)
Theo PT(1): \(n_{H_2}=n_{Fe}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2}=n_{Zn}=y\left(mol\right)\)
\(\Rightarrow x+y=0,1\)(**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}x+y=0,1\\56x+65y=12,1\end{matrix}\right.\)
Ra số âm, bn xem lại đề.
Đúng 1
Bình luận (1)
\(Fe + H_2SO_4 \rightarrow FeSO_4 + H_2\) (1)
\(Zn + H_2SO_4 \rightarrow ZnSO_4 + H_2\) (2)
\(n_{H_2}= \dfrac{2,24}{22,4}= 0,1(mol)\)
Gọi số mol Fe, Zn lần lượt là x, y (mol)
\(\Rightarrow \begin{cases} m_{Fe}= 56 x (g)\\ m_{Zn}= 65y (g) \end{cases} \)
Theo 2 PTHH:
\(n_{H_2(1)}= n_{Fe}= x (mol)\)
\(n_{H_2(2)}= n_{Zn}= y (mol)\)
Theo bài, ta có:
\(\begin{cases} m_{hh KL}= m_{Fe} + m_{Zn}= 56x + 65y =12,1 (g) (1)\\ n_{H_2}= n_{H_2(1)} + n_{H_2(2)}= x + y = 0,1 (mol) \end{cases} \)
\(\begin{cases} x= - 0,62 \\ y=0,72 \end{cases} \) (????)
Bạn xem lại đề nha
Đúng 0
Bình luận (3)


























