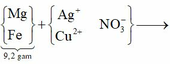đun nóng hỗn hợp gồm Al,Mg,Fe và Cu trong khí oxi dư đến khi thu được hỗn hợp rắn có khối lượng không đổi là 60g.tính thể tích oxi(đktc) đã tác dụng với hỗn hợp kim loại biết hiệu suất phản ứng là 75%
đun nóng 37,6g hỗn hợp gồm Al,Mg,Fe và Cu trong khí oxi dư đến khi thu được hỗn hợp rắn có khối lượng không đổi là 60g.tính thể tích oxi(đktc) đã tác dụng với hỗn hợp kim loại biết hiệu suất phản ứng là 75%
\(m_{hh\ rắn(lí\ thuyết)} = \dfrac{60}{75\%}=80(gam)\)
Bảo toàn khối lượng :
\(m_{O_2\ đã\ dùng} = 80 -37,6 = 42,4(gam)\\ n_{O_2} = \dfrac{43,4}{32}=1,325(mol)\\ V_{O_2} = 1,325.22,4 = 29,68(lít)\)
Đúng 1
Bình luận (0)
Đun nóng hỗn hợp A dạng bột có khối lượng 39,3 gam gồm các kim loại Mg,Al,Fe và Cu trong khí oxi dư đến khi thu được hỗn hợp rắn có khối lượng không đổi là 58,5 gam. Tính thể khí O2 (đktc) đã tác dụng với hỗn hợp kim loại.
mO2 = 58,5 - 39,3 = 19,2 (g)
nO2 = \(\frac{19,2}{32}=0,6\left(mol\right)\)
VO2 = 0,6 . 22,4 = 13,44 (lít)
Đun nóng hỗn hợp A dạng bột có khối lượng 39,3 gam gồm các kim loại Mg, Al, Fe và Cu trong không khí dư oxi đến khi thu được hỗn hợp rắn có khối lượng không đổi là 58,5 gam.
Viết các PTHH biểu diễn các phản ứng xảy ra và tính thể tích khí oxi (đktc) đã tác dụng với hỗn hợp kim loại.
PTHH :
2Mg + O2 → 2MgO(t*)
4Al + 3O2 → 2Al2O3 (t*)
3Fe +2O2 → Fe3O4 (t*)
2Cu + O2 → 2CuO (t*)
theo ĐLBTKL :
m hỗn hợp kim loại + m oxi = m hỗn hợp oxit
m oxi = m hỗn hợp oxit - m hỗn hợp kim loại
58.8-39.3=19.2 g
nO2 = 19.2 / 32 = 0.6 mol
vây thể tích khí oxi cần dùng là Vo2 = 0.6 x 22,4 =13.44(L)
Đúng 1
Bình luận (0)
\(2Mg+O_2\rightarrow2MgO\)
a............5a..............a
\(4Al+3O_2\rightarrow2Al_2O_3\)
b.............\(\dfrac{3}{4}b\)...........0,5b
\(3Fe+2O_2\rightarrow Fe_3O_4\)
c.............\(\dfrac{2c}{3}\)............\(\dfrac{1}{3}c\)
\(2Cu+O_2\rightarrow2CuO\)
d.............0,5d...........d
Theo đề ta có:
\(\Rightarrow V_{O_2}=22,4\left(0,5a+\dfrac{3}{4}b+\dfrac{2}{3}c+0,5d\right)=22,4.0,6=13,44\left(l\right)\)
Đúng 0
Bình luận (0)
\(a) \)\(PTHH:\)
\(2Mg + O2-t^o->2MgO\)
\(4Al+3O2-t^o->2Al2O3\)
\(3Fe+2O2-t^o->Fe3O4\)
\(2Cu+O2-t^o->2CuO\)
\(b)\) Ap dụng định luật bảo toàn khối lượng vào phương trình (1, 2, 3, 4)
Ta có : \(m_A + mO2 = m\)hỗn hợp oxit
\(=> mO2 = \)\(58,5-39,3 = 19,2 (g)\)
\(=> nO2 = \dfrac{19,2}{32} =0,6 (mol)\)
\(=> V_O2 = 0,6.22,4=13,44 (l)\)
Đúng 0
Bình luận (0)
Giúp mình bài này với( đề ôn thi hsg ạ): đun nóng hỗn hợp A dạng bột có khối lượng 39,3 gam gồm các kim loại Mg, Al, Fe, Cu trong khí õi dự đến khi thu đc hỗn hợp rắn có khối lượng không đổi là 58,5 gam. Tính thể tích khí oxi(điều kiện tiêu chuẩn) đã tác dụng với hỗn hợp kim loại.
T nghĩ cho cái đề vầy thì tính khối lượng mỗi kim loại thì khó hơn
Khối lượng oxi tham gia pứ:
ADĐLBTKL: \(m_{O_2}=m_{hh\left(r\right)}-m_A=58,5-39,3=19,2g\)\(n_{O_2}=\frac{19,2}{22,4}=0,6\left(mol\right)\)
\(V_{O_2}=0,6.22,4=13,44l\)
Đúng 0
Bình luận (0)
Đun nóng hh A dạng bột có khối lượng 39,3 gam gồm các kim loại Mg. Al,Fe, Cu trog khí oxi dư thu đc hh rắn có khối lượng ko đổi la 58,5 g .Viết PTHH biểu các Pư xảy ra và tính thể tích khí oxi (đktc) đã Pư
Pt: 2Mg + O2 --to--> 2MgO
.....4Al + 3O2 --to--> 2Al2O3
....3Fe + 2O2 --to--> Fe3O4
....2Cu + O2 --to--> 2CuO
Áp dụng ĐLBTKL, ta có:
mkim loại + mO2 pứ = mhh chất rắn
=> mO2 pứ = 58,5 - 39,3 = 19,2 (g)
=> nO2 pứ = \(\dfrac{19,2}{32}=0,6\) mol
=> VO2 pứ = 0,6 . 22,4 = 13,44 (lít)
Đúng 0
Bình luận (0)
Pt:
2Mg + O2 → 2MgO
4Al + 3O2 → 2Al2O3
3Fe +2O2 → Fe3O4
2Cu + O2 → 2CuO
theo ĐLBTKL :
m hỗn hợp kim loại + m oxi = m hỗn hợp oxit
m oxi = m hỗn hợp oxit - m hỗn hợp kim loại
58,5-39,3=19,2(g)
nO2 = 19,2 / 32 = 0,6 (mol)
=>VO2 = 0,6 . 22,4 =13,44(l)
Đúng 0
Bình luận (0)
Nung nóng 2,13 gam hỗn hợp X gồm ba kim loại Mg, Cu và Al ở dạng bột với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Thể tích dung dịch HCl 1M vừa đủ để phản ứng hết với Y là A. 150 ml. B. 225 ml. C. 100 ml. D. 75 ml.
Đọc tiếp
Nung nóng 2,13 gam hỗn hợp X gồm ba kim loại Mg, Cu và Al ở dạng bột với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Thể tích dung dịch HCl 1M vừa đủ để phản ứng hết với Y là
A. 150 ml.
B. 225 ml.
C. 100 ml.
D. 75 ml.
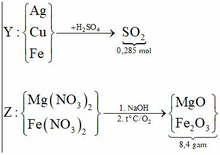
Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2, thu được chất rắn Y (gồm ba kim loại) và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 (đặc, nóng, dư), thu được 6,384 lít khí SO2 (sản phẩm khử duy nhất của S+6, ở đktc). Cho dung dịch NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe trong X là: A.79,13%. B. 28,00%. C. 70,00%. D. 60,87%.
Đọc tiếp
Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2, thu được chất rắn Y (gồm ba kim loại) và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 (đặc, nóng, dư), thu được 6,384 lít khí SO2 (sản phẩm khử duy nhất của S+6, ở đktc). Cho dung dịch NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe trong X là:
A.79,13%.
B. 28,00%.
C. 70,00%.
D. 60,87%.
Gọi số mol Mg (x); Fe trong Y là y và Fe trong Z là z
Ta có:
24x + 56y + 56z = 9,2
2x + 3y + 2z = 0,57 ( Bảo toàn e)
40x + 80z = 8,4
⇒ x = 0,15 ; y = 0,07 ; z = 0,03
%Fe = (0,1.56.100)/9,2 = 60,87%
Đáp án D
Đúng 0
Bình luận (0)
Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2, thu được chất rắn Y (gồm 3 kim loại) và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 (đặc, nóng, dư), thu được 6,384 lít khí SO2 (sản phẩm khử duy nhất của S+6, ở đktc). Cho dung dịch NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe trong X là A. 79,13%. B. 28,00%. C. 70,00%. D. 60,87%.
Đọc tiếp
Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2, thu được chất rắn Y (gồm 3 kim loại) và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 (đặc, nóng, dư), thu được 6,384 lít khí SO2 (sản phẩm khử duy nhất của S+6, ở đktc). Cho dung dịch NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe trong X là
A. 79,13%.
B. 28,00%.
C. 70,00%.
D. 60,87%.
Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2, thu được chất rắn Y (gồm 3 kim loại) và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 (đặc, nóng, dư), thu được 6,384 lít khí SO2 (sản phẩm khử của S+6, ở đktc). Cho dung dịch NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe trong X là A. 60,87%. B. 79,13%. C. 70,00%. D. 28,00%.
Đọc tiếp
Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2, thu được chất rắn Y (gồm 3 kim loại) và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 (đặc, nóng, dư), thu được 6,384 lít khí SO2 (sản phẩm khử của S+6, ở đktc). Cho dung dịch NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe trong X là
A. 60,87%.
B. 79,13%.
C. 70,00%.
D. 28,00%.
Nhận thấy 9,2 gam oxit > 8,4 gam X → nên Ag+, Cu2+ phản ứng hết
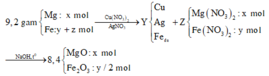
Gọi số mol Fe tham gia phản ứng là y mol, số mol Fe dư là x mol
→ nO2 pư để tạo thành Fe2O3 = y/4 mol
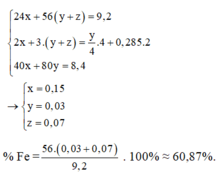
Đáp án A
Đúng 0
Bình luận (0)