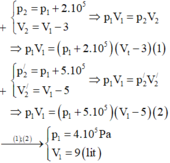Những câu hỏi liên quan
Một bình chứa 1 lượng khí ở nhiệt độ 30ºC và áp suất là 2.10^5 pa. Biết thể tích khí không đổi a) Hỏi phải tăng nhiệt độ lên đến bao nhiêu độ ( K ) để áp suất tăng gấp đôi b) Hỏi nếu giảm nhiệt độ xuống bao nhiêu độ C để áp suất giảm còn một nữa giúp với ạ :>
\(a,\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow T_2=\dfrac{T_1p_2}{p_1}=\dfrac{303.4.10^5}{2.10^5}=606^oK\\ b,T_2=\dfrac{303.10^5}{2.10^5}=151,5^oK\)
Đúng 3
Bình luận (0)
Một cái bơm chứa 80cm3 không khí ở nhiệt độ 27 độ C và áp suất 10^5 Pa. Khi không khí nén xuống còn 20cm3 và nhiệt độ tăng lên tới 327 độ C thì áp suất của không khí trong bơm là?
\(\left\{{}\begin{matrix}p_1=10^5Pa\\V_1=80cm^3\\T_1=300^oK\end{matrix}\right.\\ \left\{{}\begin{matrix}p_2=?\\V_2=20cm^3\\T_2=600^oK\end{matrix}\right.\\ \dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\Leftrightarrow\dfrac{10^5.80}{300}=\dfrac{p_2.20}{600}\\ \Rightarrow p_2=8.10^5Pa\)
Đúng 5
Bình luận (0)
Một bình chứa một lượng khí ở nhiệt độ 30 độ C và áp suất 2 bar ( 1 bar = 105 Pa ) . Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi.
Ta có : T1 = toC + 273 = 30 + 273 = 303oK
p1 = 2 bar = 2 . 105 Pa
p2 = 4 bar = 4 . 105
Vì quá trình là đẳng tích , áp dụng định luật Charles ta có
\(\frac{p_1}{p_2}=\frac{T_1}{T_2}\)→ T2 = \(\frac{p_2.T_1}{p_1}=\frac{4.10^5.303}{2.10^5}\)= 606oK
Vậy để áp suất tăng lên gấp đôi , ta phải tăng nhiệt độ lên 606oK
Đúng 0
Bình luận (0)
* Trạng thái 1: T1 = 273 + 30 = 303 K
p1 = 2 bar
* Trạng thái 2: T2 = ? p2 = 2p1
* Vì thể tích bình không đổi nên:
\(\frac{P1}{T1}=\frac{P2}{T2}\Rightarrow T2=\frac{P2.T1}{P1}=\frac{2P1.T1}{P1}\) = 2T1 = 606 K
Đúng 0
Bình luận (1)
Một bình thép chứa khí ở nhiệt độ 27 ° C và áp suất 40atm. Nếu tăng áp suất thêm 10atm thì nhiệt độ của khí trong binh là:
A. 102 ° C
B. 375 ° C
C. 34 ° C
D. 402 ° C
Đáp án: A
Vì thể tích của bóng đèn không đổi nên ta có:
p 1 T 1 = p 2 T 2 → T 2 = P 2 P 1 T 1 = 40 + 10 40 . ( 27 + 273 ) = 375 − 273 = 102 0 C
Đúng 0
Bình luận (0)
Một bình chứa một lượng khí ở nhiệt độ 30o C và áp suất 2 bar. (1 bar = 105 Pa). Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi?
Trạng thái 1: T1 = t1 + 273 = 303 K; P1 = 2 bar
Trạng thái 2: P2 = 4 bar ; T2 = ?
Áp dụng định luật Sác-lơ cho quá trình biến đổi đẳng tích, ta có:
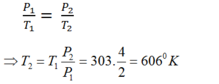
Đúng 1
Bình luận (0)
Một bình kín chứa khí ôxi ở nhiệt độ
27
°
C
và áp suất
10
5
P
a
. Nếu đem bình phơi nắng ở nhiệt độ
177
o
C
thì áp suất trong bình sẽ là: A.
1
,
5.10
5
P
a
B. ...
Đọc tiếp
Một bình kín chứa khí ôxi ở nhiệt độ 27 ° C và áp suất 10 5 P a . Nếu đem bình phơi nắng ở nhiệt độ 177 o C thì áp suất trong bình sẽ là:
A. 1 , 5.10 5 P a
B. 2 .10 5 P a
C. 2 , 5.10 5 P a
D. 3.10 5 P a
một lượng chứa một lượng khí ở nhiệt độ 30oC và áp suất 2 bar . (1 bar = 105 Pa) . Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi ?
t = 30*C => T = 303K
Quá trình đẳng tích thì áp suất tỉ lệ thuận với nhiệt độ.
Áp suất tăng gấp đôi thì nhiệt độ tăng gấp đôi => T' = 2T = 606K
=> t' = 606 - 273 = 333*C
Đúng 0
Bình luận (0)
Một bình chứa một lượng khí ở nhiệt độ 30oC và áp suất 2 bar. (1 bar = 105 Pa). Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi?
Bài giải:
* Trạng thái 1: T1 = 273 + 30 = 303 K
p1 = 2 bar
* Trạng thái 2: T2 = ? p2 = 2p1
* Vì thể tích bình không đổi nên:
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow T_2=\dfrac{p_2.T_1}{p_1}=\dfrac{2p_1.T_1}{p_1}=2T_1=606k\)
Đúng 0
Bình luận (0)
Nếu áp suất của một lượng khí tăng thêm 2. 10 5 Pa thì thể tích giảm 3 lít. Nếu áp suất tăng thêm 5. 10 5 Pa thì thể tích giảm 5 lít. Tìm áp suất và thể tích ban đầu của khí, biết nhiệt độ khí không đổi.