Có bao nhiêu electron trong ion Na+ (Z = 11)
A. 11 B. 10 C. 23 D. 22
Nguyên tử Na có 11 proton, 12 nơtron, 11 electron thì khối lượng của nguyên tử Na xấp xỉ
A. 24 u B. 23 u C. 23 gam D. 22 gam
mNa= PTK(Na)=P+N=11+12=23u
=> CHỌN B
Cho các hạt nhân nguyên tử sau đây, cùng với số khối và điện tích hạt nhân :
A(11 ; 5) ; B(23 ; 11); C(20 ; 10);
D(21 ; 10); E(10 ; 5) ; G(22 ; 10)
+ Ở đây có bao nhiêu nguyên tố hoá học ?
+ Mỗi nguyên tố có bao nhiêu đồng vị ?
+ Mỗi đồng vị có bao nhiêu electron ? Bao nhiêu nơtron ?
+ Ở đây có 3 nguyên tố hoá học ở các ô số 5, 10, 11.
Nguyên tố ở ô số 10 là neon (Z = 10). Neon có 3 đồng vị là :
![]()
Tất cả 3 đồng vị của nguyên tố neon đều có cùng số electron là 10 (bằng số proton) nhưng số nơtron lần lượt là 10, 11, 12.
![]()
Đó là 2 đồng vị của nguyên tố bo (Z = 5)
Cả 2 đồng vị của nguyên tố bo đều có 5 electron nhưng số nơtron lần lượt là 5 và 6.
B 11 23
Đó là đồng vị của nguyên tố natri (Z = 11). Đồng vị này có 11 electron và 12 nơtron.
1.Biết Na (Z = 11), Mg (Z = 12), Al ( Z = 13). Vậy các ion Na+, Mg2+, Al3+ có cùng
A.Số electron.
B .Tất cả đều đúng.
C.Số nơtron.
D.Số proton.
Nguyên tử Na (Z = 11) bị mất đi một electron thì cấu hình electron của ion tạo thành là
A. 1 s 2 2 s 2 2 p 6 3 s 1
B. 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1
C. 1 s 2 2 s 2 2 p 6
D. 1 s 2 2 s 2 2 p 6 3 s 3
Chọn C
Cấu hình electron của Na là: 1s22s22p63s1
Khi mất đi 1 electron thì cấu hình electron của ion tạo thành là: 1s22s22p6.
Các ion và nguyên tử Fe - 9 , Ne 10 , Na + 11 giống nhau về
A. số khối. B. số electron.
C. số proton. D. số nơtron
Giải đầy đủ pls
Bài 3
\(\dfrac{55}{23}+\dfrac{-22}{23}\le x\le\dfrac{1}{5}-\dfrac{-1}{6}+\dfrac{79}{30}\) có bao nhiêu số nguyên X thỏa mãn
A 1 B 2 C 3 D 4
Bài 4
Nếu \(\dfrac{-11}{12}< \dfrac{5}{x}< \dfrac{-11}{15}\) Thì x là bao nhiêu
A 5 B 6 C -5 D -6
Bài 5
\(M=\dfrac{1}{1\cdot2}+\dfrac{1}{2\cdot3}+\dfrac{1}{3\cdot4}+...+\dfrac{1}{99\cdot100}\)
A 1 B 2 C \(\dfrac{99}{100}\) D \(\dfrac{1}{100}\)
Bài 3
\(\dfrac{55}{23}+\dfrac{-22}{23}\le x\le\dfrac{1}{5}-\dfrac{-1}{6}+\dfrac{79}{30}\)
\(=\dfrac{33}{23}\)\(\le x\le\dfrac{90}{30}\)
\(=\dfrac{33}{23}\le x\le3\)
Mà \(x\in Z\) \(\Rightarrow\)\(x=2\)
Có 1 giá trị thỏa mãn
Chọn A
Bài 4
\(\dfrac{-11}{12}< \dfrac{5}{x}< \dfrac{-11}{15}\)
Chọn D
Bài 5
\(M=\dfrac{1}{1\cdot2}+\dfrac{1}{2\cdot3}+\dfrac{1}{3\cdot4}+...+\dfrac{1}{99\cdot100}\)
\(M=1-\dfrac{1}{2}+\dfrac{1}{2}-\dfrac{1}{3}+\dfrac{1}{3}-\dfrac{1}{4}+\dfrac{1}{4}-\dfrac{1}{99}+\dfrac{1}{99}-\dfrac{1}{100}\)
\(M=1-\dfrac{1}{100}\)
\(M=\dfrac{100}{100}-\dfrac{1}{100}\)
\(M=\dfrac{99}{100}\)
CHọn C
Cho nguyên tử các nguyên tố sau: Na (Z = 11), Cl (Z = 17), Ne (Z = 10), Ar (Z = 18)
Những nguyên tử nào trong các nguyên tử trên có lớp electron ngoài cùng bền vững?
Cấu hình của các nguyên tử:
+ Na (Z = 11): 1s22s22p63s1
+ Cl (Z = 17): 1s22s22p63s23p5
+ Ne (Z = 10): 1s22s22p6
+ Ar (Z = 18): 1s22s22p63s23p6
=> Chỉ có nguyên tử Ne và Ar là có 8 electron ở lớp ngoài cùng
=> Nguyên tử Ne và Ar có lớp electron ngoài cùng bền vững
Trong các ion sau : Fe3+, Na+, Ba2+, S2-, Pb2+, Cr3+, Ni2+, Zn2+, Ca2+, Cl-, H+ có bao nhiêu ion không có cấu hình electron giống khí trơ :
A. 5
B. 6
C. 7
D. 8
Đáp án B
Cấu hình khí trơ là cấu hình có 8 electron (trừ He có 2 electron ở lớp ngoài cùng).
- Các ion không có cấu hình của khí trơ là:
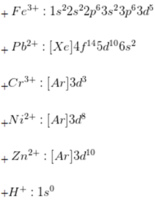
Trong các ion sau: F e 3 + , N a + , B a 2 + , S 2 - , P b 2 + , C r 3 + , N i 2 + , Z n 2 + , C a 2 + , C l - , H + có bao nhiêu ion không có cấu hình electron giống khí trơ:
A. 5
B. 6
C. 7
D. 8