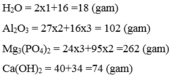Tính khối lượng của các chất sau:

Những câu hỏi liên quan
Câu 1. Tính % về khối lượng của oxi trong các chất sau: P205 ; Ca0 ; C0 ; Na20 Câu 2. Cho 3,36 lit H2 (đktc) đi qua 16 g Fe203 nung nóng tính khối lượng các chất thu được sau phản ứng
Đọc tiếp
Câu 1. Tính % về khối lượng của oxi trong các chất sau:
P205 ; Ca0 ; C0 ; Na20
Câu 2. Cho 3,36 lit H2 (đktc) đi qua 16 g Fe203 nung nóng tính khối lượng các chất thu được sau phản ứng
Câu 1 :
Trong $P_2O_5 : \%O = \dfrac{16.5}{31.2 + 16.5}.100\% = 56,34\%$
Trong $CaO : \%O = \dfrac{16}{40+16} .100\% = 28,57\%$
Trong $CO : \%O = \dfrac{16}{12 + 16}.100\% = 57,14\%$
Trong $Na_2O : \%O = \dfrac{16}{23.2 + 16}.100\% = 25,81\%$
Đúng 2
Bình luận (0)
Câu 2:
nH2=0,15(mol)
nFe2O3=0,1(mol)
PTHH: 3 H2 + Fe2O3 -to-> 2 Fe + 3 H2O
Ta có: 0,15/3 < 0,1/1
=> Fe2O3 dư, H2 hết, tính theo nFe2O3
nFe=2/3. nH2= 2/3. 0,15=0,1(mol) -> mFe=0,1.56=5,6(g)
nFe2O3(dư)= 0,1 - 1/3 . 0,15=0,05(g) -> mFe2O3=0,05.160=8(g)
Đúng 2
Bình luận (0)
Câu 2 :
$n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$n_{Fe_2O_3} = \dfrac{16}{160} = 0,1(mol)$
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
$n_{Fe_2O_3} : 1 > n_{H_2} : 3$ nên $Fe_2O_3$ dư
$n_{Fe_2O_3\ pư} = \dfrac{1}{3}n_{H_2} = 0,05(mol)$
$n_{Fe} = 2n_{Fe_2O_3\ pư} = 0,1(mol)$
$\Rightarrow m_{chất\ rắn} = 0,1.56 + 0,05.160 = 13,6(gam)$
Đúng 1
Bình luận (0)
tính khối lượng phần trăm của các nguyên tố trong các hợp chất sau:
+Tính Mg, O trong hợp chất MgO
+Tính FE trong FE2O3
`@` `\text {MgO}`
\(\text{PTK = 24 + 16 = 40 < amu>}\)
\(\%\text{O}=\dfrac{16\cdot100}{40}=40\%\)
Vậy, khối lượng `%` của `\text {O}` trong `\text {MgO}` là `40%`
`@` `\text {Fe}_2 \text {O}_3`
\(\text{PTK = }56\cdot2+16\cdot3=160\text{ }< \text{amu}\text{ }>\)
\(\%\text{Fe}=\dfrac{56\cdot2\cdot100}{160}=70\%\)
Vậy, khối lượng `%` của `\text {Fe}` trong `\text {Fe}_2 \text {O}_3` là `70%`
Đúng 1
Bình luận (7)
Tính khối lượng mol phân tử của các chất sau:
Chất A có tỉ khối hơi so với không khí bằng 2,07.
Vì dA/không khí = 2,07 ⇒ MA = 2,07.29 = 60
(vì Mkhông khí = 29)
Đúng 0
Bình luận (0)
Trộn 200ml dd Ca(OH)2 có chứa 0.5mol NAOH với 319.6g dd có chứa 0.2mol CUCL2.Lọc hổn hợp các chất sau phản ứng,thu đc kết tủa và nước lọc.Nung kết tủa đến khối lượng khôn đổi.
a) Tính khối lượng chất rắn sau nung.
b) Tính C% của các chất có trong nước lọc.
Nếu ta cho 200g dd NaOH 5% tác dụng với 36.5g dd HCl 20% thì chất nào dư sau phản ứng.
a) Viết phương trìng phản ứng xãy ra.
b) Tính khối lượng của dd thu được sau phản ứng.
c) Tính khối lượng muối tạo thành sau phản ứng.
d) Tính nồng độ % của các chất có trong dd sau phản ứng
(Giúp em vs mn ơi )
\(n_{NaOH}=\dfrac{200.5\%}{100\%.40}=0,25(mol)\\ n_{HCl}=\dfrac{36,5.20\%}{100\%.36,5}=0,2(mol)\\ a,NaOH+HCl\to NaCl+H_2O\)
Vì \(\dfrac{n_{NaOH}}{1}>\dfrac{n_{HCl}}{1}\) nên \(NaOH\) dư
\(b,n_{NaOH(dư)}=0,25-0,2=0,05(mol);n_{NaCl}=0,2(mol)\\ \Rightarrow m_{\text{dd sau p/ứ}}=0,2.58,5+0,05.40=13,7(g)\\ c,m_{NaCl}=0,2.58,5=11,7(g)\\ d,n_{H_2}=0,2(mol)\\ \Rightarrow \begin{cases} C\%_{NaOH}=\dfrac{0,05.40}{36,5+200-0,2.2}.100\%=0,85\%\\ C\%_{NaCl}=\dfrac{11,7}{36,5+200-0,2.2}.100\%=4,96\% \end{cases}\)
Đúng 2
Bình luận (0)
Tính % khối lượng của N trong các hợp chất sau: (NH2)2CO, NH4NO3, NH4Cl, NH4H2PO4. Hàm lượng N trong hợp chất nào là lớn nhất.
\(\%_{N\left(\left(NH_2\right)_2CO\right)}=\dfrac{14.2}{\left(14+2\right).2+12+16}.100\%=46,67\%\\ \%_{N\left(NH_4NO_3\right)}=\dfrac{14.2}{14.2+4+16.3}.100\%=35\%\\ \%_{N\left(NH_4Cl\right)}=\dfrac{14}{14+4+35,5}.100\%=26,17\%\\ \%_{N\left(\left(NH_4\right)H_2PO_4\right)}=\dfrac{14}{14+4+2+31+16.4}.100\%=12,17\%\)
Vậy \((NH_2)_2CO\) có hàm lượng \(N\) cao nhất
Đúng 2
Bình luận (0)
M(NH2)2CO=60g/mol
\(\Leftrightarrow\) %N[(NH2)2CO]=\(\dfrac{14.2.100}{60}\)=47%
M NH4NO3=80g/mol
\(\Leftrightarrow\) %N(NH4NO3)=\(\dfrac{14.100}{80}\)= 18%
M NH4Cl=53,5g/mol
\(\Leftrightarrow\) %N(NH4Cl)=\(\dfrac{14.100}{53.5}\)=26%
M NH4H2PO4 = 115g/mol
\(\Leftrightarrow\) %N(NH4H2PO4)=\(\dfrac{14.100}{115}\)=12%
vậy hàm lượng N trong hợp chất (NH2)2CO lớn nhất
Đúng 0
Bình luận (0)
Quan sát hình mô phỏng các phân tử sau, cho biết chất nào là đơn chất, chất nào là hợp chất? Tính khối lượng phân tử của các chất
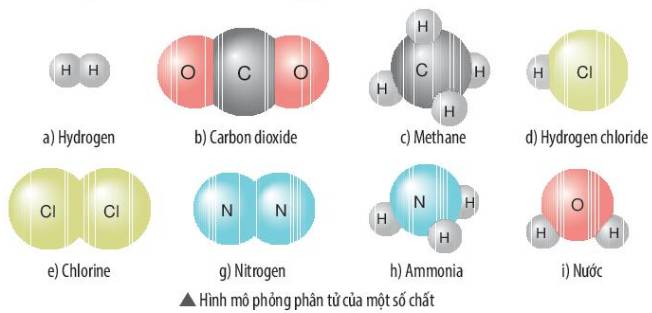
a) Hydrogen là đơn chất vì có cấu tạo từ một nguyên tố H.
Khối lượng phân tử Hydrogen: \(M_{H_2}=1
.
2=2\left(amu\right)\)
b) Carbon dioxide là hợp chất vì có cấu tạo từ 2 nguyên tố C và O.
Khối lượng phân từ Carbon dioxide: \(M_{CO_2}=12+16
.
2=44\left(amu\right)\)
c) Methane là hợp chất vì có cấu tạo từ 2 nguyên tố C và H.
Khối lượng phân tử Methane: \(M_{CH_4}=12+1
.
4=16\left(amu\right)\)
d) Hydrogen chloride là hợp chất vì có cấu tạo từ 2 nguyên tố H và Cl.
Khối lượng phân tử Hydrogen chloride: \(M_{HCl}=1+35,5=36,5\left(amu\right)\)
e) Chlorine là đơn chất vì có cấu tạo từ 1 nguyên tố là Cl.
Khối lượng phân tử Chlorine: \(M_{Cl_2}=35,5
.
2=71\left(amu\right)\)
g) Nitrogen là đơn chất vì có cấu tạo từ 1 nguyên tố N.
Khối lượng phân tử Nitrogen: \(M_{N_2}=14
.
2=28\left(amu\right)\)
h) Ammonia là hợp chất vì có cấu tạo từ 2 nguyên tố N và H.
Khối lượng phân tử Ammonia: \(M_{NH_3}=14+1
.
3=17\left(amu\right)\)
i) Nước là hợp chất vì có cấu tạo từ 2 nguyên tố H và O.
Khối lượng phân tử Nước: \(M_{H_2O}=1
.
2+16=18\left(amu\right)\)
Đúng 3
Bình luận (0)
đơn chất: hydro, clo, nitơ
hợp chất: carbon dioxide, methane, hydrogen chloride, ammonia, nước
Nguyên tử khối:
hydrogen: 2
clo: 35,5*2=71
nitơ: 28
Carbon dioxide: 44
Metan: 16
Hydrogen chloride: 36,5
Ammoniac: 17
Nước: 18
Đúng 0
Bình luận (0)
Tính khối lượng mol của các chất sau: H 2 O , A l 2 O 3 , M g 3 P O 4 2 , C a ( O H ) 2 .
Tính % khối lượng của N trong các hợp chất sau: CO2, HNO2, NaNO3, K2SO4
Trong CO2 và K2SO4 không có N mà bạn nhỉ?
HNO2: \(\%m_N=\dfrac{14}{1+14+16.2}.100\%\approx29,79\%\)
NaNO3: \(\%m_N=\dfrac{14}{23+14+16.3}.100\%\approx16,47\%\)
Đúng 2
Bình luận (0)