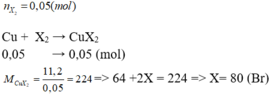Cho 3,84 gam kim loại Cu tác dụng hết với 4,26 gam khí X2 tạo thành muối CuX2. Tìm CTHH của khí X2

Những câu hỏi liên quan
Câu 6: Cho 3,84 gam Cu tác dụng hết với 4,26 gam khí X2 tạo thành m gam muối CuX2. a) Tìm khí X2 và tính m. b) Hòa tan m gam muối CuX2 trên vào 100 nước thì tạo thành dung dịch A. Cho 40 gam dung dịch Natri hidroxit 20% vào dung dịch A thì thu được kết tủa B và dung dịch D. Tính nồng độ phần trăm của dung dịch D.
giúp em với ạ
Cho 0,24 gam kim loại Mg tác dụng vừa đủ với khí Halogen X2,sau phản ứng thu được 1,84 gam muối khan.Xác định công thức và tên của muối Halogen thu được?
Xem chi tiết
PTHH: \(Mg+X_2\rightarrow MgX_2\)
Ta có: \(\dfrac{0,24}{24}=\dfrac{1,84}{24+2\cdot M_X}\) \(\Rightarrow M_X=80\)
Vậy Halogen cần tìm là Brom
Muối thu được là Magie Bromua
Đúng 2
Bình luận (0)
Cho 4,64 gam một oxit sắt tác dụng với lượng dư khí H2, lượng kim loại sinh ra đem phản ứng với dd Cu(NO3)2 dư thì thấy sinh ra 3,84 gam kim loại. Gọi tên oxi sắt.
\(n_{Cu}=\dfrac{3,84}{64}=0,06\left(mol\right)\)
CTHH: FexOy
PTHH: Fe + Cu(NO3)2 --> Fe(NO3)2 + Cu
_____0,06<--------------------------------0,06
FexOy + yH2 --to--> xFe + yH2O
\(\dfrac{0,06}{x}\)<----------------0,06
=> \(M_{Fe_xO_y}=\dfrac{4,64}{\dfrac{0,06}{x}}=\dfrac{232}{3}.x\left(g/mol\right)\)
=> x = 3 => y = 4
=> CTHH: Fe3O4
Đúng 4
Bình luận (0)
1. Cho 14,2 gam muối sunfat kim loại M tác dụng hết với dung dich BaCl2 tạo ra 23,3 g kết tủa . CTHH của muối sunfat là :
A. MgSO4 B.K2SO4 C.Na2SO4 D. Cu SO4
Cho 1,12 lít (đktc) halogen X2 tác dụng vừa đủ với đồng kim loại thu được 11,2 gam CuX2. Nguyên tố halogen là:
A. Flo
B. Clo
C. Brom
D. Iot
Cho 39 , 15 gam MnO2 tác dụng với một lượng dung dịch HCl đặc vừa đủ . Toàn bộ lượng khí thu được cho tác dụng vừa hết với 16 , 8 gam một kim loại R tạo ra m gam muối . Lấy m gam muối đó hòa tan vào nước tạo ra dung dịch X , cho dung dịch X tác dụng với lượng dư dung dịch NaOH , lọc lấy kết tủa đem nung đến khối lượng không đổi được a gam chất rắn Y .
a . Viết các phương trình phản ứng hoá học xảy ra .
b . Xác định R m và a . .
c . Hoà tan hết a gam chất rắn Y trong dung dịch H2SO4 loãng ( vừa đ...
Đọc tiếp
Cho 39 , 15 gam MnO2 tác dụng với một lượng dung dịch HCl đặc vừa đủ . Toàn bộ lượng khí thu được cho tác dụng vừa hết với 16 , 8 gam một kim loại R tạo ra m gam muối . Lấy m gam muối đó hòa tan vào nước tạo ra dung dịch X , cho dung dịch X tác dụng với lượng dư dung dịch NaOH , lọc lấy kết tủa đem nung đến khối lượng không đổi được a gam chất rắn Y . a . Viết các phương trình phản ứng hoá học xảy ra . b . Xác định R m và a . . c . Hoà tan hết a gam chất rắn Y trong dung dịch H2SO4 loãng ( vừa đủ ) thu được 100 ml dung dịch . Lấy 100ml dung dịch đó cho tác dụng với 150ml dung dịch Ba ( OH 2M được kết tủa A và dung dịch B . Nung kết tủa Á trong không khí đến khối lượng không đổi được chất rắn D . Thêm BaCl , dư vào dung dịch B thì tách ra kết tủa E Xác định khối lượng chất rắn D , kết tủa E và nồng độ mol của dung dịch B . ( coi thể tích thay đổi không đáng kể sau khi phản ứng ) .
Cho 5,4 gam nhôm (Al) tác dụng với axit clohiđric (HCl) tạo thành khí hiđro và muối nhôm clorua (AlCl3). a. Tính thể tích khí hiđro thu được (đktc) ? b. Tính khối lượng muối nhôm clorua tạo thành ? nếu sử dụng kim loại Zn tác dụng H2SO4 điều chế H2 trên, hỏi khối lượng H2SO4 cần dùng là bao nhiêu ?
a)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2----------->0,2----->0,3
=> \(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b) \(m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
c)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
0,3<----------------0,3
=> \(m_{H_2SO_4}=0,3.98=29,4\left(g\right)\)
Đúng 2
Bình luận (0)
\(a,n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2--------------->0,2------->0,3
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\\ b,m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
c, PTHH:
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,2<------------------0,2
\(m_{H_2SO_4}=0,2.98=19,6\left(g\right)\)
Cho 5,4 gam kim loại A tác dụng với khí oxi dư, thu được 10,2 gam oxit. Xác định CTHH của kim loại A?
\(n_A=\dfrac{5,4}{M_A}\left(mol\right)\)
PTHH: 2xA + yO2 --to--> 2AxOy
_____\(\dfrac{5,4}{M_A}\) ------------->\(\dfrac{5,4}{x.M_A}\)
=> \(\dfrac{5,4}{x.M_A}\left(x.M_A+16y\right)=10,2\)
=> \(M_A=9.\dfrac{2y}{x}\)
Xét \(\dfrac{2y}{x}=3=>M_A=27\left(Al\right)=>\dfrac{x}{y}=\dfrac{2}{3}=>Al_2O_3\)
Đúng 2
Bình luận (0)
\(2xA+yO_2\overset{t^o}{--->}2A_xO_y\)
Áp dụng ĐLBTKL, ta có:
\(m_A+m_{O_2}=m_{A_xO_y}\)
\(\Leftrightarrow5,4+m_{O_2}=10,2\)
\(\Leftrightarrow m_{O_2}=10,2-5,4=4,8\left(g\right)\)
\(\Rightarrow n_{O_2}=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Theo PT: \(n_{A_xO_y}=\dfrac{2}{y}.n_{O_2}=\dfrac{2}{y}.0,15=\dfrac{0,3}{y}\left(mol\right)\)
\(\Rightarrow n_{A_{\left(A_xO_y\right)}}=\dfrac{0,3}{y}.x=\dfrac{0,3x}{y}\left(mol\right)\)
Theo PT: \(n_A=\dfrac{2x}{y}.n_{O_2}=\dfrac{0,3x}{y}\left(mol\right)\)
\(\Rightarrow\dfrac{0,3x}{y}.A=5,4\)
\(\Leftrightarrow\dfrac{A}{9}=\dfrac{2y}{x}\)
Biện luận:
| 2y/x | 1 | 2 | 3 |
| A | 9 | 18 | 27 |
| loại | loại | Al |
Vậy A là nhôm (Al)
Đúng 1
Bình luận (0)
Cho 20,4 gam hỗn hợp gồm Cu và Fe tác dụng hết với 200 gam dd HCl thu được 5600 ml khí (dktc) a.Tính khối lượng mỗi kim loại b.Tính thành phần % khối lượng mỗi kim loại theo khối lượng c.Tính nồng độ % của HCL
a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,25\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,25.56=14\left(g\right)\)
mCu = 20,4 - 14 = 6,4 (g)
b, \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{14}{20,4}.100\%\approx68,63\%\\\%m_{Cu}\approx31,37\%\end{matrix}\right.\)
c, Theo PT: \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow C\%_{HCl}=\dfrac{0,5.36,5}{200}.100\%=9,125\%\)
Đúng 1
Bình luận (0)