Những câu hỏi liên quan
Oxit cao nhất của một nguyên tố ứng với công thức RO3 trong đó r chiếm 40% về khối lượng a, xác định công thức phân tử và tên gọi của oxit b, hấp thụ hết 9,6 gam oxit trên vào 90,4 g nước tính nồng độ C% của dung dịch thu được
a) Ta có: \(\dfrac{R}{R+16\cdot3}=\dfrac{40}{100}\) \(\Rightarrow R=32\) (Lưu huỳnh)
Vậy CTHH của oxit là SO3 (Lưu huỳnh trioxit)
b) PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{H_2SO_4}=\dfrac{9,6}{80}=0,12\left(mol\right)=n_{H_2SO_4}\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{0,12\cdot98}{9,6+90,4}\cdot100\%=11,76\%\)
Đúng 1
Bình luận (0)
Hấp thụ hết 2,688 lit CO2 (đktc) vào cốc đựng 150 gam dung dịch KOH a% thu được 11,4 gam muối. Tính a và nồng độ % các chất trong dung dịch thu được sau phản ứng.
Chị nghĩ đề là 2,24 sẽ hợp lý hơn nhé! Còn nếu em vẫn để số liệu là 2,688 thì hướng làm vẫn như vậy chỉ là số liệu khác nhưng mà chị tính hiện tại theo số liệu của em thì không ra.
Bài làm
\(\begin{array}{l}
{n_{C{O_2}}} = \dfrac{{2,24}}{{22,4}} = 0,1mol\\
C{O_2} + KOH \to KHC{O_3}\\
C{O_2} + 2KOH \to {K_2}C{O_3}\\
hh:KHC{O_3}(a\,mol),{K_2}C{O_3}(b\,mol)\\
\left\{ \begin{array}{l}
a + b = 0,1mol\\
100a + 138b = 11,4
\end{array} \right.\\
\Rightarrow a = 0,06;b = 0,04\\
{n_{KOH}} = {n_{KHC{O_3}}} + 2{n_{{K_2}C{O_3}}} = 0,14mol\\
{m_{KOH}} = 0,14 \times 56 = 7,84g\\
C{\% _{KOH}} = \dfrac{{7,84}}{{150}} \times 100\% = 5,227\% \\
C{\% _{KHC{O_3}}} = \dfrac{{0,06 \times 100}}{{0,1 \times 44 + 150}} \times 100\% = 3,88\% \\
C{\% _{{K_2}C{O_3}}} = \dfrac{{0,04 \times 138}}{{0,1 \times 44 + 150}} \times 100\% = 3,575\%
\end{array}\)
Đúng 0
Bình luận (0)
Lên men m gam glucozơ với hiệu suất 90%, lượng khí
C
O
2
sinh ra hấp thụ hết vào 200ml dung dịch nước vôi trong, nồng độ 0,75M. Sau phản ứng thu được 7,5 gam kết tủa trắng và khối lượng dung dịch tăng so với khối lượng dung dịch nước vôi trong ban đầu. Giá trị của m là A. 7,5 B. 15,0 C. 22,5 D. 30,0
Đọc tiếp
Lên men m gam glucozơ với hiệu suất 90%, lượng khí C O 2 sinh ra hấp thụ hết vào 200ml dung dịch nước vôi trong, nồng độ 0,75M. Sau phản ứng thu được 7,5 gam kết tủa trắng và khối lượng dung dịch tăng so với khối lượng dung dịch nước vôi trong ban đầu. Giá trị của m là
A. 7,5
B. 15,0
C. 22,5
D. 30,0
Hấp thụ hoàn toàn 5,6 lít CO2 vào dung dịch 85,5 gam dung dịch Ba(OH)2. Sau phản ứng lọc tách kết tủa thu được dung dịch có khối lượng 39,95 gam. Tính nồng độ phần trăm của dung dịch Ba(OH)2
Câu 4. Oxi hóa hoàn toàn 2,24 lít khí SO2 (đktc) trong điều kiện thích hợp thu được khí SO3. Hấp thụ hết lượng khí SO3 trên vào nước tạo thành 200 ml dung dịch X.a. Viết PTHH và xác định nồng độ mol của dung dịch X.b. Cho 3,25 gam kẽm vào dung dịch X. Tính lượng chất còn dư sau phản ứng?Câu 5. Cho 20,4 gam bột nhôm oxit Al2O3 tác dụng với dung dịch có chứa 78,4 gam axit sunfurica. Sau phản ứng, chất nào hết, chất nào dư? Dư bao nhiêu gam?b. Tính khối lượng nhôm sunfat Al2(SO4)3 thu được.Câu 6....
Đọc tiếp
Câu 4. Oxi hóa hoàn toàn 2,24 lít khí SO2 (đktc) trong điều kiện thích hợp thu được khí SO3. Hấp thụ hết lượng khí SO3 trên vào nước tạo thành 200 ml dung dịch X.
a. Viết PTHH và xác định nồng độ mol của dung dịch X.
b. Cho 3,25 gam kẽm vào dung dịch X. Tính lượng chất còn dư sau phản ứng?
Câu 5. Cho 20,4 gam bột nhôm oxit Al2O3 tác dụng với dung dịch có chứa 78,4 gam axit sunfuric
a. Sau phản ứng, chất nào hết, chất nào dư? Dư bao nhiêu gam?
b. Tính khối lượng nhôm sunfat Al2(SO4)3 thu được.
Câu 6. Cho 1,35 gam nhôm tác dụng với 200 gam dung dịch axit sunfuric 3,92%.
a. Cho biết sau phản ứng, chất nào còn dư?
b. Tính thể tích khí (đktc) thu được?
c. Tính C% của chất tan trong dung dịch sau phản ứng?
Câu 5. a) \(SO_2+\dfrac{1}{2}O_2-^{t^o,V_2O_5}\rightarrow SO_3\)
\(n_{SO_3}=n_{SO_2}=0,1\left(mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{H_2SO_4}=n_{SO_3}=0,1\left(mol\right)\)
=> \(CM_{H_2SO_4}=\dfrac{0,1}{0,2}=0,5M\)
b) \(n_{Zn}=0,05\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Lập tỉ lệ : \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\)=> Sau phản ứng H2SO4 dư
=> \(m_{H_2SO_4\left(dư\right)}=\left(0,1-0,05\right).98=4,9\left(g\right)\)
Đúng 2
Bình luận (0)
Câu 5 . \(n_{Al_2O_3}=0,2\left(mol\right);n_{H_2SO_4}=0,8\left(mol\right)\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
Lập tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,8}{3}\) => Sau phản ứng H2SO4 dư
\(m_{H_2SO_4}=\left(0,8-0,2.3\right).98=19,6\left(g\right)\)
b)\(n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,2\left(mol\right)\)
\(m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4\left(g\right)\)
Đúng 2
Bình luận (0)
Câu 6. a) \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(n_{Al}=0,05\left(mol\right);n_{H_2SO_4}=\dfrac{200.3,92\%}{98}=0,08\left(mol\right)\)
Lập tỉ lệ : \(\dfrac{0,05}{2}< \dfrac{0,08}{3}\)=> Sau phản ứng H2SO4 dư
b) \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,075\left(mol\right)\)
=> \(V_{H_2}=0,075.22,4=1,68\left(l\right)\)
c) \(m_{ddsaupu}=1,35+200-0,075.2=201,2\left(g\right)\)
\(C\%_{H_2SO_4\left(dư\right)}=\dfrac{\left(0,08-0,075\right).98}{201,2}.100=0,243\%\)
\(C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,025.342}{201,2}.100=4,25\%\%\)
Đúng 1
Bình luận (0)
hòa tan 24 gam SO3 vào nước sau phản ứng dung dịch có thể tích là 200 ml nồng độ mol của dung dịch ban đầu là
PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{SO_3}=\dfrac{24}{80}=0,3\left(mol\right)=n_{H_2SO_4}\)
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\)
Đúng 2
Bình luận (0)
hòa tan 24 gam SO3 vào nước sau phản ứng dung dịch có thể tích là 20 ml nồng độ mol của dung dịch ban đầu là
$SO_3 + H_2O \to H_2SO_4$
n H2SO4 = n SO3 = 24/80 = 0,3(mol)
20 ml = 0,02 lít
Suy ra :
CM H2SO4 = 0,3/0,02 = 15M
Đúng 3
Bình luận (0)
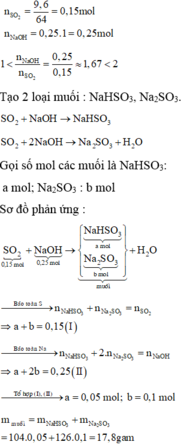
Hấp thụ hoàn toàn 9,6 gam SO2 vào 250ml dung dịch NaOH 1M. Khối lượng của muối thu được sau phản ứng là
A. 15,6 gam.
B. 18,9 gam.
C. 6,3 gam.
D. 17,8 gam.
Hấp thụ hoàn toàn m gam SO3 vào nước , thu được 200 g dung dịch H2SO4 19,6%
a,Viết phương trình hóa học của phản ứng . Tính m
b, Lấy 80 gam dung dịch H2SO4 19,6% ở trên cho tác dụng vừa đủ với MgO . Tính khối lượng MgO đã tham gia phản ứng và tính nồng độ phần trăm của dung dịch thu được sau phản ứng
\(n_{H_2SO_4}=\dfrac{200\cdot19.6\%}{98}=0.4\left(mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(0.4......................0.4\)
\(m_{SO_3}=0.4\cdot80=32\left(g\right)\)
\(b.\)
\(n_{H_2SO_4}=\dfrac{80\cdot19.6\%}{98}=0.16\left(mol\right)\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(0.16..........0.16..............0.16\)
\(m_{MgO}=0.16\cdot40=6.4\left(g\right)\)
\(m_{\text{dung dịch sau phản ứng}}=6.4+80=86.4\left(g\right)\)
\(C\%MgSO_4=\dfrac{0.16\cdot120}{86.4}\cdot100\%=22.22\%\)
Đúng 2
Bình luận (0)
a)
$SO_3 + H_2O \to H_2SO_4$
n SO3 = n H2SO4 = 200.19,6%/98 = 0,4(mol)
=> m = 0,4.80 = 32(gam)
b)
$MgO + H_2SO_4 \to MgSO_4 + H_2O$
n MgSO4 = n MgO = n H2SO4 = 80.19,6%/98 = 0,16(mol)
=> m MgO = 0,16.40 = 6,4(gam)
Sau pư, m dd = 6,4 + 80 = 86,4(gam)
=> C% MgSO4 = 0,16.120/86,4 .100% = 22,22%
Đúng 1
Bình luận (0)