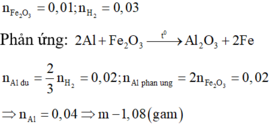Cho 16(g) Fe2O3 phản ứng với dung dịch axitHCl a,Tính mHcl b, Tím m mỗi sản phẩm

Những câu hỏi liên quan
Cho a ( g) hỗn hợp gồm Feo , Fe2o3 và Fe3o4 tác dụng với Co dư sau phản ứng thu được 3.92 g Fe . Sản phẩm khi sinh ra cho qua dung dịch ca (oh) 2 dư thu được 7 (g) kết tủa . Tính a 
$CO + O_{oxit} \to CO_2$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
Ta có :
$n_{O(oxit)} = n_{CO_2} = n_{CaCO_3} = \dfrac{7}{100} =0,07(mol)$
$\Rightarrow a = m_{Fe} + m_O = 3,92 + 0,07.16 = 5,04(gam)$
Đúng 1
Bình luận (0)
Cho 3,2 gam Fe2O3 tác dụng với dung dịch có chứa 2,19 gam HCl thu được sản phẩm là FeCl3 và H2O
a) Chất nào còn dư sau phản ứng ? Dư bao nhiêu gam ?
b) Tính khối lượng các sản phẩm thu được ?
\(n_{Fe_2O_3}=\dfrac{3.2}{160}=0.02\left(mol\right)\)
\(n_{HCl}=\dfrac{2.19}{36.5}=0.06\left(mol\right)\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(1...........6\)
\(0.02...........0.06\)
Lập tỉ lệ : \(\dfrac{0.02}{1}>\dfrac{0.06}{6}\Rightarrow Fe_2O_3dư\)
\(n_{Fe_2O_3\left(dư\right)}=0.02-\dfrac{0.06}{6}=0.01\left(mol\right)\)
\(m_{Fe_2O_3\left(dư\right)}=0.01\cdot160=1.6\left(g\right)\)
\(m_{FeCl_3}=0.02\cdot162.5=3.25\left(g\right)\)
\(m_{H_2O}=0.03\cdot18=0.54\left(g\right)\)
Đúng 2
Bình luận (2)
Dùng m gam Al để khử hết 1,6 gam Fe2O3 (phản ứng nhiệt nhôm). Sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 0,672 lít khí (đktc). Tính m.
A. 1,755 gam.
B. 0,810gam.
C. 1,080 gam.
D. 0,540gam.
Đáp án C
2Al + Fe2O3 → Al2O3 + 2Fe Khi Al dư thu :
Al + NaOH + H2O → NaAlO2 + 1,5 H2 => nAl ban đầu = 2nFe2O3 + 2/3 n H2 = 0,04 mol => m = 0,04 . 27 = 1,08 g
Đúng 0
Bình luận (0)
Dùng m gam Al để khử hết 1,6 gam Fe2O3 (phản ứng nhiệt nhôm). Sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 0,672 lít khí (đktc). Tính m. A. 0,540gam B. 0,810 gam C. 1,080 gam D. 1,755 gam
Đọc tiếp
Dùng m gam Al để khử hết 1,6 gam Fe2O3 (phản ứng nhiệt nhôm). Sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 0,672 lít khí (đktc). Tính m.
A. 0,540gam
B. 0,810 gam
C. 1,080 gam
D. 1,755 gam
Cho khí hidro qua bột sắt (III) oxit (Fe2O3). Lượng khí hidro này là sản phẩm của 6(g) magie phản ứng với dung dịch axit clohidric (HCl) . Tính khối lượng sắt (III) oxit ban đầu
Mg+2HCl->MgCl2+H2
0,25--------------------0,25 mol
3H2+Fe2O3-to>2Fe+3H2O
0,25-----1\12-------------1\6 mol
n Mg=6\24=0,25 mol
=>m Fe=1\6 .56=9,33g
=>m Fe2O3=1\12.160=13.33g
Đúng 0
Bình luận (0)
\(n_{Mg}=\dfrac{6}{24}=0,25\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: 0,25 0,25
PTHH: Fe2O3 + 3H2 → 2Fe + 3H2O
Mol: 1/12 0,25
\(m_{Fe_2O_3}=\dfrac{1}{12}.160=13,33\left(g\right)\)
Đúng 0
Bình luận (0)
Dùng m gam Al để khử hết 32 gam Fe 2 O 3 đến khi phản ứng hoàn toàn, sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 3,36 lít khí (đktc). Tính m.
A. 10,80 gam
B. 8,10 gam
C. 13,50 gam
D. 17,55 gam
Dùng m gam Al để khử hết 1,6 gam Fe 2 O 3 đến khi phản ứng hoàn toàn, sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 0,672 lít khí (đktc). Tính m?
A. 1,080 gam
B. 0,810 gam
C. 0,540 gam
D. 1,755 gam
Cho kim loại Na tác dụng với nước thu được 3,36 lít H2(đktc)
A)tính khối lượng Na đã phản ứng và khối lượng sản phẩm tạo thành
B)nếu cho quỳ tím vào dung dịch sau phản ứng, quỳ tím có đổi màu không?
C)với thể tích khí trên có thể khử được bao nhiêu g sắt (III) oxit
a. PTPƯ : 2Na + 2H2O ---> 2NaOH + H2
+ nH2 = 0,15 mol
+ nNa = 2 nH2 =0,3 mol
=> mNa =n.M= 6,9 g
+ nNaOH = nNa = 0,3 mol
=> mNaOH = n. M= 0,3 . 40= 12 gam
b. Quỳ tím hóa xanh
Đúng 0
Bình luận (0)
Bài 6Hòa tan 16 g Fe2O3 vào axit HCl ( vừa đủ) thu được dung dịch A.Cho dung dịch A tác dụng vừa đủ với 200 ml dung dịch KOH tạo ra m (g) kết tủa. a- Tính khối lượng của axit HCl phản ứng b-Tính nồng độ mol của dung dịch KOH và khối lượng của m.
Đọc tiếp
Bài 6
Hòa tan 16 g Fe2O3 vào axit HCl ( vừa đủ) thu được dung dịch A.Cho dung dịch A tác dụng vừa đủ với 200 ml dung dịch KOH tạo ra m (g) kết tủa.
a- Tính khối lượng của axit HCl phản ứng
b-Tính nồng độ mol của dung dịch KOH và khối lượng của m.
a, \(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(FeCl_3+3KOH\rightarrow3KCl+Fe\left(OH\right)_{3\downarrow}\)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
Theo PT: \(n_{HCl}=6n_{Fe_2O_3}=0,6\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,6.36,5=21,9\left(g\right)\)
b, \(n_{Fe\left(OH\right)_3}=n_{FeCl_3}=2n_{Fe_2O_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe\left(OH\right)_3}=0,2.107=21,4\left(g\right)\)
\(n_{KOH}=3n_{FeCl_3}=0,6\left(mol\right)\)
\(\Rightarrow C_{M_{KOH}}=\dfrac{0,6}{0,2}=3\left(M\right)\)
Đúng 2
Bình luận (0)