Cho 13,7 gam Ba tan hết vào V ml dung dịch A l 2 S O 4 3 Sau khi các phản ứng kết thúc thấy khối lượng dung dịch giảm 10,59 gam so với ban đầu. Giá trị của V gần nhất với giá trị nào sau đây
A. 260
B. 185
C. 355
D. 305
Cho 13,7 gam Ba tan hết vào V ml dung dịch Al2(SO4)3 0,1M. Sau khi các phản ứng kết thúc thấy khối lượng dung dịch giảm 10,59 gam so với ban đầu. Giá trị của V gần nhất với giá trị nào sau đây?
A. 260
B. 185
C. 355
D. 305
Cho 13,7 gam Ba tan hết vào V ml dung dịch Al2(SO4)3 0,1M. Sau khi các phản ứng kết thúc thấy khối lượng dung dịch giảm 10,59 gam so với ban đầu. Giá trị của V gần nhất với giá trị nào sau đây?
A. 260
B. 185
C. 355
D. 305
Đáp án D
Định hướng tư duy giải
Ta có:
Câu 6. Hòa tan hoàn toàn 5,85 gam K và 13,7 gam Ba vào 400 ml H2O thu được dung dịch F, Tính nồng độ %, nồng độ mol/l của dung dịch F
hòa tan 13,7 g Ba vào 1 lít dd H2SO49,8%(D=1,25g/ml)
tính nồng độ % của dung dịch
Thảo Phương Phùng Hà Châumuốn đặt tên nhưng chưa nghĩ ra bạn nào tốt nghĩ giùm mkKKagamine Len love Vocaloid02hánh Như Trương NgọcNguyễn Anh ThưTrầTen Hoàngn Ánh ThuTrần Ánh ThuNguyễn Thị Kiều Duyênhuyền thoại đêm trăng
đổi 1l = 1000ml
mddH2SO4 = 1000.1,25= 1250g
nBa=13,7/137=0,1mol
pt : Ba + H2SO4 -----> BaSO4 + H2
npứ 0,1 --->0,1
mH2SO4 = 0,1 . 98 = 9,8g
C%(H2SO4)=\(\dfrac{9,8}{1250}.100=0,784\%\)
\(n_{Ba}=\dfrac{13,7}{137}=0,1\left(mol\right)\)
Vì Ba là kim loại mạnh có tính kiềm nên khi p/ứ với dd H2SO4, Ba sẽ p/ứ với nước có trong dd axit sau đó mới p/ứ với axit
\(PTHH:Ba+H_2O\rightarrow Ba\left(OH\right)_2+H_2\uparrow\)(1)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+H_2O\) (2)
\(m_{ddH_2SO_4}=1000.1,25=1250\left(g\right)\)
\(\Rightarrow m_{H_2SO_4}=\dfrac{49,8.1250}{100}=622,5\left(g\right)\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{622,5}{98}=\dfrac{1245}{196}\approx6,35\left(mol\right)\)
Theo PT (1) : \(n_{Ba\left(OH\right)_2}=n_{Ba}=0,1\left(mol\right)\)
Theo PT (2) Lập tỉ lệ ta thấy H2SO4 dư
Sau p/ứ dung dịch thu được là H2SO4 dư còn BaSO4 là kết tủa nên không phải là dung dịch
\(\Rightarrow n_{H_2SO_4du}=\dfrac{1245}{196}-0,1=\dfrac{6127}{980}\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=\dfrac{6127}{980}.98=612,7\left(g\right)\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{612,7}{1250}.100=49,016\%\)
Hòa tan hết 4 gam SO3 vào nước dư được 200 ml dung dịch X chứa H2SO4 a mol/l. Trung hòa X cần dùng V ml dung dịch NaOH 0,25M. Tính a, V ?
\(n_{SO_3}=\dfrac{4}{80}=0,05\left(mol\right)\)
PTHH: SO3 + H2O ----> H2SO4
Mol: 0,05 0,25
\(a=C_{M_{H_2SO_4}}=\dfrac{0,25}{0,2}=1,25M\)
PTHH: H2SO4 + 2NaOH -----> Na2SO4 + 2H2O
Mol: 0,25 0,5
\(b=V_{ddNaOH}=\dfrac{0,5}{0,25}=2\left(l\right)=2000\left(ml\right)\)
Các bạn giúp mình 2 câu này với
Câu 2. Trộn 39,2gam dung dịch H2SO4nồng độ 25% vào 16gam dung dịch NaOH 30%. Tìm nồng độ % các chất tan trong dung dịch sau phản ứng.
Câu 3. Hòa tan 13,7 gam Ba trong 250ml H2O (D = 1,008 g/ml) thu được dung dịch X và khí Y (đktc)a) Tính C% của dung dịch X.b) Lấy 212,4 gam dung dịch X tác dụng với 14,7 gam dung dịch H2SO440% thu được dung dịch Z. Tìm C% các chất tan trong Z.
Câu 2:
\(m_{H_2SO_4}=39,2.25\%=9,8\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
\(m_{NaOH}=16.30\%=4,8\left(g\right)\Rightarrow n_{NaOH}=\dfrac{4,8}{40}=0,12\left(mol\right)\)
PTHH: H2SO4 + 2NaOH → Na2SO4 + 2H2O
Mol: 0,06 0,12 0,06
Ta có: \(\dfrac{0,1}{1}>\dfrac{0,12}{2}\) ⇒ H2SO4 dư, NaOH hết
mdd sau pứ = 39,2+16 = 55,2 (g)
\(C\%_{ddH_2SO_4dư}=\dfrac{\left(0,1-0,06\right).98.100\%}{55,2}=7,1\%\)
\(C\%_{ddNa_2SO_4}=\dfrac{0,06.142.100\%}{55,2}=15,43\%\)
Câu 3.
a)\(n_{Ba}=\dfrac{13,7}{137}=0,1\left(mol\right)\)
PTHH: Ba + 2H2O → Ba(OH)2 + H2
Mol: 0,1 0,1 0,1
mdd sau pứ = 13,7+250.1,008-0,1.2 = 265,5 (g)
\(C\%_{ddBa\left(OH\right)_2}=\dfrac{0,1.171.100\%}{265,5}=6,44\%\)
Cho 13,7 gam Ba vào 100 ml dung dịch HCl 1M thu được dung dịch X. Cho dung dịch X vào 100 ml dung dịch FeSO4 0,7 M thu được kết tủa Y. Khối lượng kết tủa Y là
A. 16,31 gam
B. 25,31 gam
C. 20,81 gam
D. 14,50 gam
Chọn đáp án C.
Dung dịch X có nBaCl2 = 0,05, nBa(OH)2 = 0,05
=> n S O 4 2 - < nBa2+ và nFe2+ <nOH- => mRắn = 0,07 × 233 + 0,05 × 90 = 20,81 gam
Hòa tan hết 17,72 gam hỗn hợp X gồm Al2O3 và FeCO3 cần dùng vừa đủ 280 ml dung dịch H2SO4 1M, thu được dung dịch Y. Cho V ml dung dịch Ba(OH)2 1M vào dung dịch Y, thu được 77,36 gam kết tủa. Giá trị lớn nhất của V là:
A. 320
B. 240
C. 280
D. 260
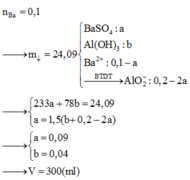
Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước thu được dung dịch Y và 13,44 lít H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y thu được m gam kết tủa. Lấy m gam kết tủa đó cho tan hết trong V mL dung dịch KOH 1,25M. Giá trị tối thiểu của V là
A. 240.
B. 360.
C. 320.
D. 220.
Đáp án A
%mO/X = 86,3×0,1947 = 16,8 gam.
⇒ nO = 1,05 ⇒ nAl2O3 = 0,35 mol.
Ta có ∑nOH– = 2nH2 = 1,2 mol.
⇒ Dung dịch Y chứa nAlO2– = nAl/Al2O3 = 0,7 mol || nOH dư = 0,5 mol.
+ Sau phản ứng trung hòa nH+ = 3,2×0,75 – 0,5 = 1,9 mol
⇒ nAl(OH)3 = 0,7 – 1 , 9 - 0 , 7 3 = 0,3 mol.
+ Cho 0,3 mol Al(OH)3 phản ứng với KOH ta có phản ứng:
Al(OH)3 + KOH → KAlO2 + 2H2O ||⇒ nKOHcần dùng = 0,3.
⇒ VKOH = 0 , 3 1 , 25 = 0,24 lít = 240 ml