Tương tác van der Waals là gì? Tồn tại ở đâu ?
- Nêu ảnh hưởng của tương tác van der Waals nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng phân tử
- Trong các khí hiếm He, Ne, Ar, Kr. Khí nào có nhiệt độ nóng chảy thấp nhất và cao nhất?
Lực Van der Waals là một loại tương tác giữa các phần tử có tiếp xúc với nhau, được đặt tên của nhà vật lý người Hà Lan Johannes Diderik van der Waals, mô tả một loại tương tác phụ thuộc vào khoảng cách giữa các phần tử, công bố đầu tiên vào năm 1873. Các phần tử tham gia vào lực này thường là phân tử.
Thực chất, lực Van der Waals là lực tĩnh điện, thường xuất hiện giữa các phân tử chất khí, khí hóa lỏng hoặc hóa rắn, và trong hầu hết các chất lỏng và chất rắn hữu cơ.
- Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
-Tương tác van der Waals làm tăng nhiệt độ sôi và nhiệt độ nóng chảy. ⟹ Khí hiếm có nhiệt độ nóng chảy thấp nhất là He và cao nhất là Xe.
Đúng 0
Bình luận (0)
Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?
A. Ne
B. Xe
C. Ar
D. Kr
Trong cùng 1 nhóm, đi từ trên xuống dưới, khối lượng phân tử tăng, kích thước phân tử tăng
=> Tương tác van der Waals tăng
=> Nhiệt độ sôi, nhiệt độ nóng chảy tăng
=> Ne có nhiệt độ sôi thấp nhất
Đáp án A
Đúng 1
Bình luận (0)
Khí hiếm có 8e ở lớp ngoài cùng trừ :
A, Ar B, H
C, He D,Ne
Viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố thuộc nhóm VIIIA (He, Ne, Ar, Kr, Xe, Rn).
Hãy cho biết đặc điểm về cấu hình electron lớp ngoài cùng của các nguyên tử trên và từ đó cho biết đặc điểm về tính chất của các nguyên tố tương ứng.
He: 1 s 2 ; Ne: 2 s 2 2 p 6 ; Ar: 3 s 2 3 p 6
Kr: 4 s 2 4 p 6 ; Xe: 5 s 2 5 p 6 ; Rn: 6 s 2 6 p 6
Nguyên tử của các nguyên tố trong nhóm (trừ heli) đều có 8 electron ở lớp ngoài cùng với cấu hình ns 2 np 6 . Đó là cấu hình electron vững bền. He có cấu hình 1 s 2 , nhưng với cấu hình đó, lớp electron ngoài cùng đã bão hoà nên He cũng là một nguyên tử vững bền.
Các nguyên tố thuộc nhóm VIIIA được gọi là các khí hiếm. Các khí hiếm đều khó tham gia các phản ứng hoá học. Ở điều kiện thường, các nguyên tử không liên kết với nhau tạo thành phân tử. ở điều kiện thường, các khí hiếm đều ở trạng thái khí, phân tán.
Đúng 0
Bình luận (0)
Kim loại có nhiệt độ nóng chảy cao nhất và thấp nhất trong tất cả các kim loại lần lượt là
A. W và K.
B. Fe và Li.
C. Cr và K.
D. W và Hg.
Kim loại có nhiệt độ nóng chảy cao nhất và thấp nhất trong tất cả các kim loại lần lượt là
A. W và K
B. Fe và Li
C. Cr và K
D. W và Hg
Kim loại có nhiệt độ nóng chảy cao nhất và thấp nhất trong tất cả các kim loại lần lượt là
A. Fe và Li
B. W và K
C. W và Hg
D. Cr và K
Kim loại có nhiệt độ nóng chảy cao nhất và thấp nhất trong tất cả các kim loại lần lượt là
A. W và K.
B. Fe và Li.
C. Cr và K.
D. W và Hg.
Quan sát Hình 6.1, so sánh số electron lớp ngoài cùng của He, Ne và Ar
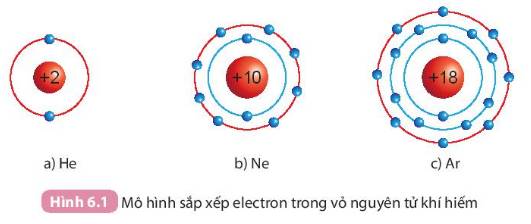
Số electron lớp ngoài cùng của Ne = Ar = 8
Số electron lớp ngoài cùng của He = 2
=>He ít số electron lớp ngoài cùng hơn Ne và Ar
Đúng 1
Bình luận (0)
Số electron lớp ngoài cùng của các nguyên tố `He` nhỏ hơn số electron ngoài cùng của nguyên tố `Ar,Ne`
Số electron ngoài cùng của nguyên tố `Ar, Ne` bằng nhau `(` đều `=8e)`
Đúng 1
Bình luận (0)
Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe
B. Ne
C. Ar
D. Kr
Bài 1: Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe
B. Ne
C. Ar
D. Kr
Đúng 2
Bình luận (0)



















