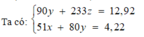KHẨN CẦU MỌI NGƯỜI GIẢI NHANH GIÚP EM VỚI Ạ!!! :câu 1:Dung dịch X chứa các ion: Fe2+ (0,1 mol), Al3+ (0,2 mol), Cl- (x mol), SO42- (y mol). Cô cạn dung dịch X thu được 44,4 gam muối rắn. Tìm giá trị x và y?Câu 2 : Cho 5,1 gam hỗn hợp Al và Mg tác dụng với dung dịch HNO3 loãng dư, thu được dung dịch X và 1,12 lít khí N2 (đktc, sản phẩm khử duy nhất). Khối lượng muối thu được trong X là?Câu 3 : Trộn 200ml dung dịch gồm HCl 0,01M và H2SO4 0,02M với 300ml dung dịch KOH 0,03M. Tính pH dung dịch thu đ...
Đọc tiếp
KHẨN CẦU MỌI NGƯỜI GIẢI NHANH GIÚP EM VỚI Ạ!!! :<<<<
câu 1:Dung dịch X chứa các ion: Fe2+ (0,1 mol), Al3+ (0,2 mol), Cl- (x mol), SO42- (y mol). Cô cạn dung dịch X thu được 44,4 gam muối rắn. Tìm giá trị x và y?
Câu 2 : Cho 5,1 gam hỗn hợp Al và Mg tác dụng với dung dịch HNO3 loãng dư, thu được dung dịch X và 1,12 lít khí N2 (đktc, sản phẩm khử duy nhất). Khối lượng muối thu được trong X là?
Câu 3 : Trộn 200ml dung dịch gồm HCl 0,01M và H2SO4 0,02M với 300ml dung dịch KOH 0,03M. Tính pH dung dịch thu được?
(Cho biết Fe=56; Al=27; Cl=35,5; S=32; O=16; H=1; N=14)