Một lượng khí có thể tích 200 c m 3 ở nhiệt độ 16 ° C và áp suất 740 mmHg. Thể tích của lượng khí này ở điều kiện chuẩn là :
A. V0= 18,4 c m 3 B. V0= 1,84 m 3
C. V0= 184 c m 3 D. V0= 1,02 m 3
Trong phòng thí nghiệm, người ta điều chế được 40 cm3 khí hidro ở áp suất 750 mmHg và nhiệt độ 27o C. Tính thể tích của lượng khí trên ở điều kiện chuẩn (áp suất 760 mmHg và nhiệt độ 0o C)
Trạng thái 1:
P1 = 750 mmHg
T1 = 27 + 273 = 300 K
V1 = 40 cm3
Trạng thái 2:
Po = 760 mmHg
To = 0 + 273 = 273 K
Vo = ?
Áp dụng phương trình trạng thái của khí lí tưởng:
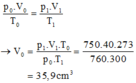
Trong phòng thí nghiệm người ta điều chế được 40 cm 3 khí hiđrô ở áp suất 750 mmHg và nhiệt độ 27 ° C . Thể tích của lượng khí trên ở điều kiện tiêu chuẩn (áp suất 760 mmHg và nhiệt độ 0 ° C ) bằng
A. 23 cm 3 .
B. 32,5 cm 3
C. 35,9 cm 3
D. 25,9 cm 3
1. Trong phòng thí nghiệm, người ta điều chế được 20 dm' khi ở áp suất 750 mmlg và nhiệt độ 37°C . Thể tích của lượng khi trên ở điều kiện chuẩn là bao nhiêu cm" Biết ở điều kiện tiêu chuẩn áp suất 740 mmHg và nhiệt độ 0 C.
Ta có: \(\dfrac{p_1\cdot V_1}{T_1}=\dfrac{p_2\cdot V_2}{T_2}\)
\(\Rightarrow\dfrac{20\cdot750}{37+273}=\dfrac{V_2\cdot740}{0+273}\)
\(\Rightarrow V_2=17,85dm^3=17,85l\)
Đổi 20dm3=20000cm3
Áp dụng pt trạng thái:
(P1.V1):T1 = (P2.V2):T2
⇒( 750.20000):310 = (740.V2): 273
⇒V2= 17851 cm3
Trong phòng thí nghiệm, người ta điều chế được 40 c m 3 khí hidro ở áp suất 750 mmHg và nhiệt độ 27 ° C . Thể tích của lượng khí trên ở điều kiện chuẩn (áp suất 760 mmHg và nhiệt độ 0 ° C ) có giá trị gần nhất với giá trị nào sau đây?
A. 36 c m 3
B. 400 c m 3
C. 43 c m 3
D. 2 c m 3
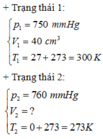
+ Áp dụng phương trình trạng thái của khí lí tưởng ta có:
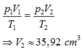
=> Chọn A.
Trong phòng thí nghiệm, người ta điều chế được 40 cm3 khí hidro ở áp suất 750 mmHg và nhiệt độ 27oC. Tính thể tích của lượng khí trên ở điều kiện chuẩn (áp suất 760 mmHg và nhiệt độ 0oC)
Bài giải.
+ Trạng thái 1:
p1 = 750 mmHg
T1 = 300 K
V1 = 40 cm3
+ Trạng thái 2 :
P0 = 760 mmHg
T0 = 273 K
V0 = ?
+ Phương trình trạng thái :
\(\dfrac{p_0V_0}{T_0}=\dfrac{p_1V_1}{T_1}\Rightarrow V_0=\dfrac{p_1V_1}{T_1}.\dfrac{T_0}{p_0}\)
\(V_0=\dfrac{750.40.273}{760.300}=36cm^3\)
trong phòng thí nghiệm , người ta điều chế được 40 cm3 khí hidro ở áp suất 750 mmHg và nhiệt độ 27oC . Tính thể tích của lượng khí trên ở điều kiện chuẩn (áp suất 760 mmHg và nhiệt độ 0oC ).
Áp dụng pt trạng thái: (P1.V1):T1= (P2.V2):T2
<=> (750x40):300= (760.V2):273
Giải pt tìm được V2
Người ta điều chế 100 cm3 khí Oxi ở áp suất 750 mmHg và nhiệt độ 37C. a) Nén đẳng nhiệt khối khí trên đến thể tích 50 cm3 . Xác định áp xuất của khối khí khi đó. b) Tính thể tích của khối khí trên ở điều kiện chuẩn ( áp suất 760 mmHg và nhiệt độ 0 C)
Tham khảo ạ :
\(a,\\ 750mmHg=1atm\\ P_1V_1=P_2V_2\\ \Rightarrow P_2=\dfrac{P_1V_1}{V_2}=\dfrac{10^{-3}}{5.10^{-4}}=2\left(atm\right)\\ b,\dfrac{P_1V_1}{RT_1}=\dfrac{P_2V_2}{RT_2}\\ \Rightarrow P_1=P_2\\ \Rightarrow\dfrac{V_1}{T_1}=\dfrac{V_2}{T_2}\Rightarrow V_2=\dfrac{V_1T_2}{T_1}\\ =8,8.10^{-5}m^3\)
trong phòng thí nghiệm , điều chế được 40 cm3 khí hidro ở áp suất 750 mmHg và ở nhiệt độ 27oC . Thể tích của lượng khí trên ở áp suất 760 mmHg và ở nhiệt độ 0oC gần bằng bao nhiêu ?
+ Trạng thái 1:
p1 = 750 mmHg
T1 = 300 K
V1 = 40 cm3
+ Trạng thái 2 :
P0 = 760 mmHg
T0 = 273 K
V0 = ?
+ Phương trình trạng thái :
=
=> V0 =
.
V0= = 36 cm3
6.28. Một hỗn hợp không khí gồm 23,6g ôxi và 76,4g nitơ. Tính: a) Khối lượng của 1 mol hỗn hợp. b) Thể tích hỗn hợp ở áp suất 750 mmHg, nhiệt độ 27°C. c) Khối lượng riêng của hỗn hợp ở điều kiện trên. d) Áp suất riêng phần của ôxi và nitơ ở điều kiện trên. Bài giải