Đốt hỗn hợp bột S và Zn trong bình kín theo tỉ lệ 1 : 2,5 về khối lượng. Sau khi phản ứng hoàn toàn thu được chất rắn X.
Cho X phản ứng với dung dịch HCl dư thu được khí Y.
Xác định thành phần của khí Y (S=32, Zn=65).
Đốt hỗn hợp bột S và Zn trong bình kín theo tỉ lệ 1 : 2 về khối lượng. Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn X.Xác định thành phẩn của chất rắn X (Zn = 65, S=32).
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H 2 bằng 5. Tỉ lệ a:b bằng
A. 2:1
B. 1:1
C. 3:1
D. 3:2
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a:b bằng:
A. 2:1
B. 1:1
C. 3:1
D. 3:2
đốt nóng 1 hỗn hợp gồm 16,8g bột sắt và 6,4g bột lưu huỳnh trong môi trường không có không khí, ta thu được hỗn hợp rắn X. cho hỗn hợp X phản ứng hoàn toàn với dung dịch HCl dư thu được hỗn hợp khí Y. Thành phần % theo thể tích của hỗn hợp khí Y là
Do hòa tan X vào dd HCl dư thu được hỗn hợp khí
=> Trong X chứa Fe
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\); \(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: Fe + S --to--> FeS
0,2<-0,2---->0,2
Fe + 2HCl --> FeCl2 + H2
0,1------------------->0,1
FeS + 2HCl --> FeCl2 + H2S
0,2---------------------->0,2
=> \(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,1}{0,1+0,2}.100\%=33,33\%\\\%V_{H_2S}=\dfrac{0,2}{0,1+0,2}.100\%=66,67\%\end{matrix}\right.\)
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\\ n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: Fe + S --to--> FeS
LTL: 0,3 > 0,2 => Fe dư
Theo pthh: nFe (pư) = nS = nFeS = 0,2 (mol)
=> nFe (dư) = 0,3 - 0,2 = 0,1 (mol)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,1------------------------->0,1
FeS + 2HCl ---> FeCl2 + H2S
0,2--------------------------->0,2
=> \(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,1}{0,1+0,2}.100\%=33,33\%\\\%V_{H_2S}=100\%-33,33\%=66,67\%\end{matrix}\right.\)
Fe+ S → FeS (1)
FeS+2HCL→FeCl2+H2S (2)
Fe(dư)+2HCL→FeCl2+H2 (3)
HCL(dư)+NaOH→NaCl+H2 (4)
Thành phần của hỗn hợp khí Y:
Theo (1) : 0,2mol Fe tác dụng với 0,2mol S, sinh ra 0,2 mol FeS.
Theo (2) : 0,2 mol FeS tác dụng với HCL, sinh ra 0,2 mol H2S
Theo (3) : 0,1 moi Fe dư tác dụng với HCL, sinh ra 0,1 mol HCl
Kết luận : Hỗn hợp khí A có thành phần phần trăm theo thể tích :
66,7% khí H2S và 33,3% khí H2
Nung nóng hỗn hợp bột gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 75%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 là 5,0. Tỉ lệ a : b là
A. 3 : 1.
B. 2 : 1.
C. 1 : 2.
D. 1 : 3.
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50% thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a : b bằng:
A. 2 : 1
B. 1 : 1
C. 3 : 1
D. 3 : 2
Đáp án A
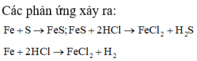
Hỗn hợp khí Z gồm H2S và H2. Đặt nFe=1mol . Dựa vào phương trình phản ứng ta thấy vì số mol khí sinh ra luôn là 1 mol với bất kì hiệu suất và tỉ lệ a:b nào nên:
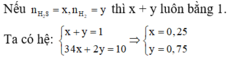
Theo đề bài hiệu suất phản ứng là 50% nhưng do chưa biết Fe hay S dư nên phải xét hai trường hợp. Tuy nhiên khi nhìn vào đáp án có thể thấy số mol sắt lớn hơn số mol lưu huỳnh nên hiệu suất được tính theo lưu huỳnh. Bảo toàn lưu huỳnh suy ra
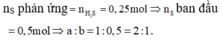
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50% thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a : b bằng:
A. 2 : 1
B. 1 : 1
C. 3 : 1
D. 3 : 2
Đáp án A
Các phản ứng xảy ra:
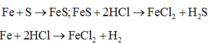
Hỗn hợp khí Z gồm H2S và H2. Đặt nFe=1mol . Dựa vào phương trình phản ứng ta thấy vì số mol khí sinh ra luôn là 1 mol với bất kì hiệu suất và tỉ lệ a:b nào nên:
Nếu ![]() thì x + y luôn bằng 1. Ta có hệ:
thì x + y luôn bằng 1. Ta có hệ:
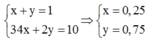
Theo đề bài hiệu suất phản ứng là 50% nhưng do chưa biết Fe hay S dư nên phải xét hai trường hợp. Tuy nhiên khi nhìn vào đáp án có thể thấy số mol sắt lớn hơn số mol lưu huỳnh nên hiệu suất được tính theo lưu huỳnh. Bảo toàn lưu huỳnh suy ra
nS phản ứng
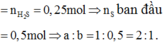
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50% thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a : b là
Xét `a<b->H` tính theo `Fe.`
`Fe+S` $\xrightarrow{t^o}$ `FeS`
`0,5a->0,5a->0,5a(mol)`
Có `n_{Fe\ pu}=0,5a(mol)`
`Y` gồm `Fe:0,5a(mol);S:b-0,5a(mol);FeS:0,5a(mol)`
`FeS+2HCl->FeCl_2+H_2S`
`Fe+2HCl->FeCl_2+H_2`
Theo PT: `n_{H_2S}=n_{FeS}=0,5a(mol);n_{H_2}=n_{Fe}=0,5a(mol)`
`->{n_{H_2S}}/{n_{H_2}}={5.2-2}/{34-5.2}=1/3`
``->{0,5a}/{0,5a}=1/3` vô lí.
Xét `a>b->H` tính theo `S.`
`Fe+S` $\xrightarrow{t^o}$ `FeS`
`0,5b←0,5b->0,5b(mol)`
Có `n_{S\ pu}=0,5b(mol)`
`Y` gồm `Fe:a-0,5b(mol);S:0,5b(mol);FeS:0,5b(mol)`
`FeS+2HCl->FeCl_2+H_2S`
`Fe+2HCl->FeCl_2+H_2`
Theo PT: `n_{H_2S}=n_{FeS}=0,5b(mol);n_{H_2}=n_{Fe}=a-0,5b(mol)`
`->{n_{H_2S}}/{n_{H_2}}={5.2-2}/{34-5.2}=1/3`
``->{0,5b}/{a-0,5b}=1/3`
`->1,5b=a-0,5b`
`->a=2b`
`->a:b=2:1`
Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hoàn toàn chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt. Hòa tan hết hỗn hợp này trong một lượng dung dịch HCl ( lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của N+5 là khí NO duy nhất). Giá trị của m là
A. 6,72.
B. 5,60.
C. 5,96.
D. 6,44.