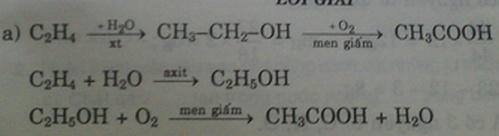Chọn hóa chất thích hợp và viết phương trình hóa học để loại các khí S O 2 , C O 2 ra khỏi hỗn hợp khí CO.

Những câu hỏi liên quan
Hai hợp chất hữu cơ X, Y có cùng phân tử khối là 46 đvC, đều chứa các nguyên tố C, H, O và mỗi chất chỉ chứa một loại nhóm chức đã học, có các tính chất sau: – X, Y tác dụng với Na giải phóng khí H2. – Dung dịch Y làm quì tím hóa đỏ. a) Xác định công thức phân tử, công thức cấu tạo của X, Y và viết các phương trình hóa học xảy ra. b) Chất Y có trong nọc kiến. Khi bị kiến cắn, để giảm sưng tấy nên chọn chất nào bôi vào vết thương trong số các hóa chất sau: vôi tôi, giấm ăn, nước, muối ăn. Viết ph...
Đọc tiếp
Hai hợp chất hữu cơ X, Y có cùng phân tử khối là 46 đvC, đều chứa các nguyên tố C, H, O và mỗi chất chỉ chứa một loại nhóm chức đã học, có các tính chất sau:
– X, Y tác dụng với Na giải phóng khí H2.
– Dung dịch Y làm quì tím hóa đỏ.
a) Xác định công thức phân tử, công thức cấu tạo của X, Y và viết các phương trình hóa học xảy ra.
b) Chất Y có trong nọc kiến. Khi bị kiến cắn, để giảm sưng tấy nên chọn chất nào bôi vào vết thương trong số các hóa chất sau: vôi tôi, giấm ăn, nước, muối ăn. Viết phương trình hóa học giải thích cho lựa chọn đó.
c) Cho 13,8 gam hỗn hợp gồm X, Y phản ứng hết với Na vừa đủ, thu được V lít khí H2 (đktc) và m gam chất rắn. Tính giá trị V, m.
a.
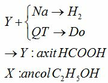
b.Chọn vôi tôi hoặc nếu có kem đánh răng cũng được
2HCOOH + Ca(OH)2 → (HCOO)2Ca + 2H2O
c) HCOOH + Na → HCOONa + ½ H2
C2H5OH + Na → C2H5ONa + ½ H2
n(X, Y) = 2.nH2 → nH2 = 0,15 → V = 3,36 (lít)
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm, quá trình điều chế khí Z thường bị lẫn SO2. Để loại bỏ SO2 ra khỏi hỗn hợp khí gồm Z và SO2, có thể dùng dung dịch chứa chất nào trong các chất ( riêng biệt) sau đây: BaCl2, Ca(OH)2, Br2 và K2SO3? Giải thích và viết phương trình hóa học minh họa cho các phản ứng.
Trong phòng thí nghiệm, quá trình điều chế khí Z thường bị lẫn SO2 nên Z là C2H4.
Vậy để tách SO2 ra khỏi hỗn hợp C2H4 và SO2 ta có thể dùng các chất: Ca(OH)2, K2SO3.
PTHH:
SO2 + Ca(OH)2 → CaSO3↓ + H2O
K2SO3 + SO2 + H2O → 2KHSO3
Đúng 0
Bình luận (0)
cho các chất sau: H2O, H2SO4, Ca(OH)2, Chọn chất loại bỏ khí CO2 , SO2. Viết phương trình hóa học minh họa.
Hoàn thành phương trình hóa học và xác định tỉ lệ số nguyên tử, số phân tử của 2 cặp chất tùy chọn trong các phản ứng sau:
a. K + O 2 ----> K 2 O.
\(a,4K+O_2\xrightarrow{t^o}2K_2O\\ \text{Số nguyên tử K }:\text{Số phân tử }O_2=4:1\)
Đúng 3
Bình luận (0)
a) Hãy viết phương trình hóa học của các phản ứng giữa hiđro với hỗn hợp đồng (II) oxit và sắt (III) oxit ở nhiệt độ thích hợp?. b) Trong các phản ứng hóa học trên, chất nào là chất khử, chất nào là chất oxi hóa? Vì sao? c) Nếu thu được 6,00 gam hỗn hợp hai kim loại, trong đó có 2,8g sắt thì thể tích (ở đktc) khí hiđro vừa đủ cần dùng để khử đồng (II) oxit và sắt (III) oxit là bao nhiêu?
Đọc tiếp
a) Hãy viết phương trình hóa học của các phản ứng giữa hiđro với hỗn hợp đồng (II) oxit và sắt (III) oxit ở nhiệt độ thích hợp?.
b) Trong các phản ứng hóa học trên, chất nào là chất khử, chất nào là chất oxi hóa? Vì sao?
c) Nếu thu được 6,00 gam hỗn hợp hai kim loại, trong đó có 2,8g sắt thì thể tích (ở đktc) khí hiđro vừa đủ cần dùng để khử đồng (II) oxit và sắt (III) oxit là bao nhiêu?
a) Phương trình hóa học của các phản ứng:
H2 + CuO → Cu + H2O (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b) Trong phản ứng (1), (2) chất khử H2 vì chiếm oxi của chất khác, chất oxi hóa là CuO và Fe2O3 vì nhường oxi cho chất khác.
c) Khối lượng đồng thu được từ 6g hỗn hợp 2 kim loại thu được:
mCu = 6g - 2,8g = 3,2g, nCu = 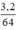 = 0,05 mol
= 0,05 mol
nFe = 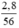 = 0,05 (mol)
= 0,05 (mol)
nH2 (1) = nCu = 0,05 mol ⇒ VH2(1) = 22,4 . 0,05 = 1,12 lít
nH2 (2) = 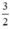 . nFe =
. nFe = 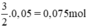 ⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
VH2 = VH2(1) + VH2(2) = 1,12 + 1,68 = 2,8(l)
Đúng 0
Bình luận (0)
Chọn các chất thích hợp thay vào các chữ cái rồi viết các phương trình hóa học theo những sơ đồ chuyển hóa sau:
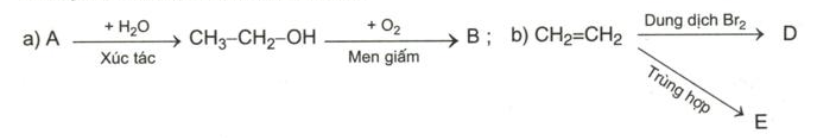
b) :
\(CH_2=CH_2 + Br_2 \to CH_2Br-CH_2Br(D)\\ nCH_2=CH_2 \xrightarrow{t^o,p,xt} -(CH_2-CH_2-)_n(E)\)
Đúng 1
Bình luận (0)
Dạng 2:a. Nêu phương pháp hóa học làm sạch khí etilen có lẫn khí cacbonic. b. Trình bày phương pháp hóa học để thu được khí CH4 tinh khiết từ hỗn hợp khí gồm CH4, C2H4 và C2H2 . Viết PTHH xảy ra . c. Trình bày cách tách khí cacbonic ra khỏi hỗn hợp gồm metanvà cacbonic.
a) ta sục qua Ca(Oh)2
thu đcC2H4
Ca(oH)2+CO2->CaCO3+H2O
c)
ta sục qua Ca(Oh)2 thì thu đc CH4
sau đó nung nóng thì thu đc CO2
Ca(oH)2+CO2->CaCO3+H2O
CaCO3-to>CaO+CO2
Đúng 1
Bình luận (0)
hãy viết phương trình hóa học biểu diễn phản ứng hóa hợp của lưu huỳnh với các kim loại sau (biết trong hợp chất S có hóa trị 2) a.nhôm b.sắt c.chì d.natri
Xem chi tiết
\(2Al+3S\underrightarrow{t^0}Al_2S_3\)
\(Fe+S\underrightarrow{t^0}FeS\)
\(Pb+S\underrightarrow{t^0}PbS\)
\(2Na+S\underrightarrow{t^0}Na_2S\)
Đúng 1
Bình luận (1)
a) 2 Al + 3 S -to-> Al2S3
b) Fe + S -to-> FeS
c) Pb + S -to-> PbS
d) 2 Na + S -to-> Na2S
Đúng 1
Bình luận (0)
a. S + Al → Al2S3.
b. Fe + S → FeS.
c. Pb + S → PbS.
d. Na + S → Na2S.
(Tất cả các phản ứng trên đều có nhiệt độ nha.)
Đúng 0
Bình luận (0)
Chỉ dùng thêm 1 hóa chất, hãy phân biệt các chất trong những dãy sau và viết phương trình hóa học để giải thích. Các kim loại: Al, Mg, Ca, Na.
Nhận biết Al, Mg , Ca, Na
- Cho nước vào 4 mẫu thử:
+ Mẫu kim loại tan trong nước tạo thành dung dịch trong suốt là Na
+ Mẫu kim loại tan trong nước tạo dung dịch vẩn đục là Ca
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
+ Hai mẫu thử không tan trong nước là Al và Mg
- Hai kim loại không tan trong nước ta cho dung dịch NaOH vào, kim loại nào phản ứng có khí bay ra là Al, còn lại là Mg
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Đúng 0
Bình luận (0)