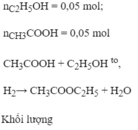
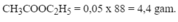Cho 0,1 mol C H 3 C O O H tác dụng với 0,15 mol C H 3 C H 2 O H thu được 0,05 mol C H 3 C O O C 2 H 5 . Tính hiệu suất phản ứng.

Những câu hỏi liên quan
cho hỗn hợp gồm 0,3 mol Fe, 0,15 mol Fe2O3 và 0,1 mol Fe3O4 tác dụng vừa đủ với dung dịch H2SO4 loãng thu được dung dịch A. Cho dung dich A tác dụng với NaOH dư, lọc kết tủa đem nung trong không khí đến khối lượng không đổi thu được m gam chất rắn C. Giá trị của m là...
ta có : \(n_{Fe\left(hh\right)}=0,3+0,15.2+0,1.3=0,9\left(mol\right)\)
chất rắn C sẽ là \(Fe_2O_3\)
Ta có PTHH chung
\(2Fe--->Fe_2O_3\)
\(0,9\) \(0,45\) (mol)
\(\Rightarrow m_{Fe_2O_3}=72\left(g\right)\) \(\Rightarrow m_{rC}=72\left(g\right)\)
Đúng 0
Bình luận (0)
Ta có một dảy chuyển hóa như sau:
Fe --> FeSO4 --> Fe(OH)2 --> Fe2O3
0.3-----------------------------------...
Fe2O3 --> Fe2(SO4)3 --> Fe(OH)3 --> Fe2O3
0.15----------------------------------...
Fe3O4 --> Fe2(SO4)3 và Fe(SO4)2 --> Fe(OH)2 và Fe(OH)3 --> Fe2O3
0.1-----------------------------------...
=> nFe2O3 = 3*0.15 = 0.45 (mol)
=> mFe2O3 = 72g
Đúng 0
Bình luận (0)
Đốt a gam
C
2
H
5
O
H
thu được 0,1 mol
C
O
2
. Đốt b gam
C
H
3
C
O
O
H
thu được 0,1 mol
C
O
2
. Cho a gam
C
2
H
5
O
H
tác dụng với b gam
C
H
3
C
O
O...
Đọc tiếp
Đốt a gam C 2 H 5 O H thu được 0,1 mol C O 2 . Đốt b gam C H 3 C O O H thu được 0,1 mol C O 2 . Cho a gam C 2 H 5 O H tác dụng với b gam C H 3 C O O H (giả sử hiệu suất phản ứng là 100%) thu được c gam este. Tìm giá trị của c (cho H=1, C=12, O=16).
Dung dịch X có chứa: Na+:0,1 mol; NH4+:0,2 mol; CO32– :x mol. Dung dịch Y có chứa: Ba2+:0,15 mol; OH– :y mol. Trộn dung dịch X vào dung dịch Y thu được m gam kết tủa Z ,V lít khí T (đktc) và dung dịch H. Tính m? V? CM ion trong H (Biết Vdd H= 20ml )
Xem thêm câu trả lời
Hỗn hợp X gồm 0,1 mol C3H4; 0,15 mol C2H4 ; 0,2 mol C2H6 và 0,3 mol H2. Đun nóng X với bột Ni xúc tác 1 thời gian được hỗn hợp Y. Đốt cháy hoàn toàn hỗn hợp Y .Tính số gam của CO2 và H2O
nC=nCO2=1mol=>mCO2=44g
nH=2,8mol=>nH2O=1,4=>mH2O=25,2g
Bài 3:
1/ Một hợp chất thuộc bazơ có khối lượng mol phân tử là 78g. Tìm tên kim loại trong bazơ đó.
2/ Cho 12,6g kim loại A có hóa trị n tác dụng hết với 0,15 mol O2. Chất rắn thu được cho tác dụng với dung dịch HCl dư thu được 13,44 lít H2 (đktc).
a. Viết các PTHH.
b. Xác định kim loại A.
Bài 3)
Câu 1)
Gọi CTHH của bazơ cần tìm là A(OH)x
- Ta có: \(M_{A\left(OH\right)_x}=M_A+17x\)
+) Lập bảng:
| x | 1 | 2 | 3 |
| MA | 61(loại) | 44(loại) | 27(nhận:Al) |
Vậy: kim loại A cần tìm trong bazơ đó là nhôm (Al=27)
Đúng 0
Bình luận (0)
2) \(4A+nO_2\underrightarrow{t^o}2A_2O_n\)
16,2g A thì đúng hơn đó, 12,6 nó chả ra kim loại phù hợp
Đúng 0
Bình luận (0)
1. Cho lượng dư dung dịch AgNO3 tác dụng với hỗn hợp gồm 0,1 mol NaF và 0,1 mol NaCl. khối lượng kết tủa là bao nhiêu gam ?
2. hòa tan 0,6g 1 kim loại hóa trị II vào 1 lượng HCl dư. Sau phản ứng khối lượng muối thu được bao nhiêu gam?
1.
Ta có PT
AgNO3 + NaF ---> không xảy ra pư
AgNO3 + NaCl ---> AgCl↓ + NaNO3
.0,1............0,1.............0,1
=>m\(AgCl\)= 143,5.0,1 = 14,35(g)
Đúng 1
Bình luận (0)
Bài 2 : Hãy tìm công thức hóa học của hợp chất có khối lượng mol là 40 g/mol, thành phần cá
c
nguyên tố : 57% Na, 40% O
và còn lại là H.
Bài 3 :
Cho 48g Fe
2
O
3
tác dụng vừa đủ với HCl, sản phầm tạo thành gồm FeCl
3
và H
2
O. Tính khối
lượng HCl
cần dùng
và khối lượng FeCl
3.
sinh ra
Xem chi tiết
Bài 2
\(\%Na:\%O:\%H=57:40:3\)
\(\Rightarrow n_{Na}:n_O:n_H=\frac{57}{23}:\frac{40}{16}:\frac{3}{1}\)
\(=2,48:2,5:3\approx1:1:1\)
\(\Rightarrow CTHH:NaOH\)
Bài 3
\(Fe2O3+6HCl-->2FeCl3+3H2O\)
\(n_{FE2O3}=\frac{48}{160}=0,3\left(mol\right)\)
\(n_{FeCl3}=2n_{Fe2O3}=0,6\left(mol\right)\)
\(m_{FeCl3}=0,6.133,5=80,1\left(g\right)\)
\(n_{HCl}=6n_{Fe2O3}=1,8\left(mol\right)\)
\(m_{HCl}=1,8.36,5=65,7\left(g\right)\)
Cho 16,2 gam M có hóa trị n tác dụng với 0,1 mol O2, chất rắn thu được tác dụng với HCl dư tạo ra 13,44 lít H2 (ĐKTC). Tìm M = ?
Gợi ý đáp số M = Mg
Đặt a là số mol của M , b là số mol của \(o_2\) phản ứng (b=0,1)
+ Đặt a là số mol của M; b là số mol O2 phản ứng (b = 0,15).
M → Mn +ne−
a → na
O2+4e−→2O−2
0,1→0,4M
+ Do kim loại chưa bị O2 oxi hóa hết nên H+ (HCl) sẽ oxi hóa tiếp.
2H++2e−→H2 (1,2)←(0,4 )
+ Ta có ∑ne−∑ne− nhường = ∑ne−∑ne− nhận
⇒na=0,4+1,2=1,6
⇒a=1,6n
MM=ma=16,21,8n=9nMM=ma=16,21,8n=9n
n=3⇒M=27 (Al)
\(O_2\) +4e- \(\rightarrow\) 2\(O\)-2
Đúng 0
Bình luận (0)
Cho 6,3 gam một kim loại R có hóa trị không đổi tác dụng hoàn toàn với 0,15 mol O2. Chất rắn thu được sau phản ứng đem hòa tan vào dung dịch HCl ( dư ) thấy thoát ra 1,12 lít khí H2 ở đktc. Xác định kim loại R.
PTHH: \(4R+xO_2\rightarrow2R_2O_x\\ \dfrac{0,6}{x}mol:0,15mol\rightarrow\dfrac{0,3}{x}mol\)
\(R_2O_x+2xHCl\rightarrow2RCl_x+xH_2O\)
\(R+xHCl\rightarrow RCl_x+\dfrac{x}{2}H_2\\ \dfrac{0,1}{x}mol:0,1mol\leftarrow\dfrac{0,1}{x}mol:0,05mol\)
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(n_R=\dfrac{0,6}{x}+\dfrac{0,1}{x}=\dfrac{0,7}{x}\)
\(M_R=\dfrac{m_R}{n_R}=6,3:\dfrac{0,7}{x}=9x\)
| x | 1 | 2 | 3 |
| \(M_R\) | 9 | 18 | 27 |
| loại | loại | Al |
Đúng 0
Bình luận (0)
PTHH:4R+xO2→2R2Ox0,6xmol:0,15mol→0,3xmol
R2Ox+2xHCl→2RClx+xH2O
R+xHCl→RClx+x2H20,1xmol:0,1mol←0,1xmol:0,05mol
nH2=1,1222,4=0,05(mol)
nR=0,6x+0,1x=0,7x
MR=mRnR=6,3:0,7x=9x
| x | 1 | 2 | 3 |
| MR | 9 | 18 | 27 |
| loại | loại | Al |
Đúng 0
Bình luận (0)
Bài 1: Tính số nguyên tử có trong các lượng chất sau:
a. 0,75 mol nguyên tử Fe c. 0,1 mol nguyên tử H
b. 1,4 mol nguyên tử C d. 0,15 mol nguyên tử Cu
Bài 2: Tính số mol của các chất sau:
a. 0,65g Zn b. 10g CaCO3 c.22,4g CaO d. 0,48g cacbon
Bài 3: Tính thể tích của các lượng chất sau ở đktc:
a. 0,25mol CO2 b. 4,8g O3 c. 9.1023 phân tử H2 d. 8,8 g CO2
Câu 4: Tính khối l...
Đọc tiếp
Bài 1: Tính số nguyên tử có trong các lượng chất sau:
a. 0,75 mol nguyên tử Fe c. 0,1 mol nguyên tử H
b. 1,4 mol nguyên tử C d. 0,15 mol nguyên tử Cu
Bài 2: Tính số mol của các chất sau:
a. 0,65g Zn b. 10g CaCO3 c.22,4g CaO d. 0,48g cacbon
Bài 3: Tính thể tích của các lượng chất sau ở đktc:
a. 0,25mol CO2 b. 4,8g O3 c. 9.1023 phân tử H2 d. 8,8 g CO2
Câu 4: Tính khối lượng của các lượng chất sau:
a. 0,5 mol H b. 0,75 mol O3 c. 0,25 mol H2SO4 d. 2,5mol Al2(SO4)3
Câu 5: Tính khối lượng của các lượng chất sau:
a. 3,36 lít khí NH3 ở đktc b. 0,45 mol phân tử CaCO3
Bài 6: Tính khối lượng của các lượng chất sau:
a. 0,15 mol phân tử CO2 b.0,2 mol phân tử CaCO3
c. 0,12 mol phân tử O2 d. 0,25 mol phân tử NaCl
lqphuc2006
1.
Số NT Fe=0.75*6*10^23=4.5*10^23
Số NT C=1.4*6*10^23=8.4*10^23
Số NT H=0.1*6*10^23=0.6*10^23
Số NT Cu=0.15*6*10^23=0.9*10^23
2.
nZn=0.65/65=0.1mol
nCaCO3=10/100=0.1mol
nCaO=22.4/56=0.4mol
nC=0.48/12=0.04mol
câu 3
VCO2=0,25.22,4=5,6 l
nO3=4,8\4,8=0,1 mol
=>VO3=0,1.22,4=2,24 l
Số mol của H2
n=sophantu\6.1023=9.1023\6.1023=1,5(mol)
⇒⇒ VH2(đktc) =n.22,4=1,5.22,4=33,6(lít)
nCO2=8,8\44=0,2 mol
=>VCo2=0,2.22,4=4,48 l
Câu 4: Tính khối lượng của các lượng chất sau:
a. 0,5 mol H b. 0,75 mol O3 c. 0,25 mol H2SO4 d. 2,5mol Al2(SO4)3
mH2=0,5.2=1 g
mO3=0,75.48=36 g
mH2SO4=0,25.98=24,5 g
mAl2(SO4)3=2,5.342=855 g