Công thức tính nồng độ phần trăm là
A. C % = m c t m d d . 100 %
B. C % = n v . 100 %
C. C % = m c t m d d
D. C % = 2 v
Nồng độ phần trăm là gì? Viết công thức tính nồng độ phần trăm.
Nồng độ phần trăm (kí hiệu C%) của một dung dịch cho ta biết số gam chất tan có trong 100 gam dung dịch.
Công thức: 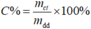
Trong đó: m ct : khối lượng chất tan (gam); m dd : khối lượng dung dịch (gam).
Dung dịch là gì? Viết công thức tính nồng độ mol? Nồng độ phần trăm?
Cứu e với
- Dung dịch là hỗn hợp đồng nhất giữa chất tan và dung môi.
- Công thức tính nồng độ mol: \(C_M=\dfrac{n}{V}\)
- Công thức tính nồng độ %: \(C\%=\dfrac{m_{ct}}{m_{dd}}.100\%\)
A)Viết công thức nồng độ phần trăm và nồng độ mol/l ghi chú các đại lượng
B) Vận dụng công thức tính nồng độ phần trăm của dung dịch thu được khi hòa tan 4g CUSO4 vào 100g nước.
A, C%= ( mct.100%) / mdd
Trong đó: mct: khối lượng chất tan
mdd: khối lượng dung dịch
CM= n / V
Trong đó: n: số mol chất tan
V: thể tích dung dịch
B,
mdd CuSO4= 4+100= 104 (g)
C%= 4.100% /104 \(\approx\)3,85 %
B) Khối lượng dung dịch là:
mdd=mct+mdm=4+100=104(g)
Áp dụng công thức: C%=mct/mdd.100%
-> C%dd= 4/104.100%=3,85%
A) - C%=mct/mdd.100%
Trong đó: C% là nồng độ phần trăm của dung dịch
mct là khối lượng chất tan (g)
mdd là khối lượng của dung dịch (g)
- CM=n/V
Trong đó: CM là nồng độ mol của dung dịch
n là số mol chất tan
V là thể tích dung dịch, biểu thị bằng lít
Tìm và chứng minh công thức liên hệ giữa nồng độ phần trăm và nồng độ mol của dd.
Công thức liên hệ giữa CM và C%
CM=\(\dfrac{10.D.C}{M}\)
Nếu không nhớ đc CT này bn có thể quy đổi như sau:
- Giả sử có 100g dd ZlCl2 , ----> mct (ZlCl2) = 25g----> n ZlCl2
- Từ D----> V dd
-CM = n/V ---> điều cần tìm
9 / Hãy viết công thức tính nồng độ phần trăm , khối lượng chất tan, khối lượng dung dịch và nồng độ mol/l . ( 1đ
Nồng độ phần trăm :
C% = \(\dfrac{m_{ct}}{m_{dd}}.100\%\)
Khối lượng chất tan = mdd - m dung môi
Khối lượng dung dịch = mctan + mdung môi
Nồng độ mol CM = n/v
\(C\% = \dfrac{m_{chất\ tan}}{m_{dung\ dịch}}.100\%\\ m_{chất\ tan} = m_{dd}.C\%\\ m_{dung\ dịch} = \dfrac{m_{chất\ tan}}{C\%}\\ C_M = \dfrac{n_{chất\ tan}}{V_{dung\ dịch}}\)
trong một phòng thí nghiệm có hai dd hcl (dd A và dd B) có nồng độ khác nhau. Nồng độ phần trăm của B lớn gấp 2,5 lần nồng độ phần trăm của A. Khi trộn hai dd trên theo tỉ lệ khối lượng là 3:7 thì được dd C có nồng độ phần trăm của A. Biết trong phòng thí nghiệm, dd HCl có nồng độ phần trăm lớn nhất là 37%. Tính nồng độ phần trăm của dd A và B
Có lẽ khi nãy anh chị hiểu lầm nên đã xoá mất câu hỏi của em rồi=))
Lập công thức liên hệ giữa nồng độ phần trăm, khối lượng riêng và nồng độ mol.
Đáp án để các anh chị check: \(C_M=\dfrac{C\%.10D}{M}\)
Nồng độ mol thể hiện liên quan hệ giữa số mol của một chất tan và thể tích dung dịch. Công thức tính nồng độ mol như sau: nồng độ mol = nồng độ chất tan / số lít dung dịch
Để tìm nồng độ mol, bạn cần có số mol và thể tích dung dịch theo lít. Nếu các giá trị này không được cho trước, nhưng bạn biết thể tích và khối lượng của dung dịch, bạn có thể xác định số mol chất tan trước khi tính nồng độ mol.
Ví dụ:
Khối lượng = 3,4 g KMnO4
Thể tích = 5,2 L
Tính phân tử khối của chất tan
Để tính số mol chất tan từ khối lượng hoặc số gam chất tan đó, trước hết bạn cần xác định phân tử khối của chất tan. Phân tử khối của chất tan có thể được xác định bằng cách cộng nguyên tử khối của mỗi nguyên tố có trong dung dịch. Để tìm nguyên tử khối của mỗi nguyên tố, hãy sử dụng bảng tuần hoàn các nguyên tố hóa học.
Ví dụ:
Nguyên tử khối của K = 39,1 g
Nguyên tử khối của Mn = 54,9 g
Nguyên tử khối của O = 16,0 g
Tổng nguyên tử khối = K + Mn + O + O + O + O = 39,1 + 54,9 + 16 + 16 + 16 + 16 = 158,0 g
Đổi gam sang số mol
Sau khi đã có phân tử khối, bạn cần nhân số gam chất tan trong dung dịch với hệ số chuyển đổi tương đương của 1 mol trên phân tử khối của chất tan. Kết quả phép nhân này là số mol của chất tan.
Ví dụ: số gam chất tan * (1 / phân tử khối của chất tan) = 3,4 g * (1 mol / 158 g) = 0,0215 mol
Chia số mol cho số lít
Bạn đã tính được số mol, bây giờ hãy chia số mol đó cho thể tích dung dịch theo đơn vị lít, bạn sẽ có nồng đô mol của dung dịch đó.
Ví dụ: nồng độ mol = số mol chất tan / số lít dung dịch = 0,0215 mol / 5,2 L = 0,004134615
Ghi lại kết quả
Bạn cần làm tròn kết quả theo yêu cầu của giáo viên, thường là hai đến ba số sau dấu phẩy. Ngoài ra, khi viết kết quả, hãy viết tắt “nồng độ mol” là “M” và kèm theo đó kí hiệu hóa học của chất tan.
Ví dụ: 0,004 M KMnO4
mk lm xong bài cho bn rồi đấy nhưng ko chắc lắm 50/50 thôi và có cả ví dụ luôn rồi bn:)) bạn học tốt
Bt3:cho thêm 60g H20 vào 400g dung dịch h2so4 98%.tính nồng độ phần trăm dung dịch h2so4 mới
Bt4:làm bay hơi 40g h20 từ 1 kg dung dịch nacl 60%.tính nồng độ phần trăm nacl còn lại
Bt5:cho 24,6g nhôm tác dụng với 200g dung dịch h2s04 27,375%.
A.tính nồng độ phần trăm của các chất có trong dung dịch sau phản ứng
B.dùng lượng khí sinh ra khử hết 64g 1 oxit kim loại.xác định công thức hóa học của oxit kim loại trên
Mình đang cần gấp
Bt3:cho thêm 60g H20 vào 400g dung dịch h2so4 98%.tính nồng độ phần trăm dung dịch h2so4 mới
--
mH2SO4= 98%. 400= 392(g)
mddH2SO4(mới)= 60+400=460(g)
=> \(C\%_{ddH2SO4\left(mới\right)}=\frac{392}{460}.100\approx85,217\%\)
Bt4:làm bay hơi 40g h20 từ 1 kg dung dịch nacl 60%.tính nồng độ phần trăm nacl còn lại
mNaCl= 60%.1= 0,6(kg)=600(g)
mddNaCl(Sau)= 1000-40=960(g)
=> \(C\%_{ddNaCl\left(sau\right)}=\frac{600}{960}.100=62,5\%\)
Bt5:cho 24,6g nhôm tác dụng với 200g dung dịch h2s04 27,375%.
A.tính nồng độ phần trăm của các chất có trong dung dịch sau phản ứng
B.dùng lượng khí sinh ra khử hết 64g 1 oxit kim loại.xác định công thức hóa học của oxit kim loại trên
---
A) nAl= 24,6/27= 41/45(mol)
mH2SO4=27,375%.200= 54,75(g)
=> nH2SO4= 54,75/98=219/392(mol)
PTHH: 2 Al + 3 H2SO4 -> Al2(SO4)3 + 3 H2
Ta có: 41/45 : 2 > 219/392 :3
=> Al dư, H2SO4 hết, tính theo nH2SO4
Chất trong dd sau p.ứ là Al2(SO4)3
nAl2(SO4)3= nH2SO4/3= 219/392 :3=73/392(mol)
=> mAl2(SO4)3= 73/392 . 342\(\approx63,689\%\)
B) Anh thấy số hơi xấu nên câu B sẽ không tính ra em nhé!
Cho 1,44 g kim loại M tác dụng với 58,4 g dung dịch HCl vừa đủ thu được 1,344 lít khí ở điều kiện tiêu chuẩn và dung dịch A.
a) Tìm M.
b) Tính nồng độ phần trăm của axit HCl.
c) Tính nồng độ phần trăm của muối có trong dung dịch A.
2M + 2nHCl → 2MCln + nH2
\(n_{H_2}=\frac{1,344}{22,4}=0,06\left(mol\right)\)
\(n_M=\frac{1,44}{M_M}\left(mol\right)\)
a) Theo PT: \(n_M=\frac{2}{n}n_{H_2}=\frac{0,12}{n}\left(mol\right)\)
\(\Leftrightarrow\frac{1,44}{M_M}=\frac{0,12}{n}\)
\(\Rightarrow M_M=\frac{1,44n}{0,12}\)
Lập bảng:
| n | 1 | 2 | 3 |
| MM | 12 | 24 | 36 |
| loại | Mg | loại |
Vậy M là Mg
b) PTHH: Mg + 2HCl → MgCl2 + H2
Theo PT: \(n_{HCl}=2n_{H_2}=0,12\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,12\times36,5=4,38\left(g\right)\)
\(\Rightarrow C\%_{ddHCl}=\frac{4,38}{58,4}\times100\%=7,5\%\)
c) \(m_{H_2}=0,06\times2=0,12\left(g\right)\)
\(m_{dd}saupư=1,44+58,4-0,12=59,72\left(g\right)\)
Theo PT: \(n_{MgCl_2}=n_{H_2}=0,06\left(mol\right)\)
\(\Rightarrow m_{MgCl_2}=0,06\times95=5,7\left(g\right)\)
\(\Rightarrow C\%_{MgCl_2}=\frac{5,7}{59,72}\times100\%=9,54\%\)