Khi đốt cháy hoàn toàn 15 mg chất A chỉ thu được khí C O 2 và hơi nước, tổng thể tích của chúng quy về đktc là 22,4 ml. CTĐGN của A?
A. C H 4 O 2
B. C H 2 O
C. C H 4
D. C 2 H 4 O
Khi đốt cháy hoàn toàn 15 miligam chất A chỉ thu được khí CO2 và hơi nước, tổng thể tích của chúng quy về điều kiện tiêu chuẩn là 22,4 mililít. Công thức đơn giản nhất của A là
A. CH2O
B. CH2
C. CH4O
D. C3H4
Đốt cháy hoàn toàn 0,30 gam chất A (phân tử chỉ chứa C, H, O) thu được 0,44 gam khí cacbonic và 0,180 gam nước. Thể tích hơi của 0,30 gam chất A bằng thể tích của 0,16 gam khí oxi (ở cùng điều kiện về nhiệt độ và áp suất). Xác định công thức phân tử của chất A.
Gọi công thức hợp chất hữu cơ là CxHyOz (x,y,z nguyên dương)
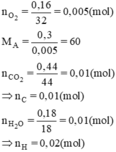
mO = mA – (mC + mH) = 0,3 - (0,01.12 + 0,02.1) = 0,16(g)
⇒ nO = 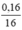 = 0,01(mol)
= 0,01(mol)
nC : nH : nO = 0,01 : 0,02 : 0,01 = 1 : 2 : 1
⇒ công thức phân tử (CH2O)n
Ta có: mA = 30n = 60 ⇒ n = 2
⇒ Công thức phân tử của A là C2H4O2
2. Đốt cháy hoàn toàn 23 gam hợp chất A cần 33,6 lít ôxi (đktc) và thu được thể tích CO2 bằng 2/3 thể tích hơi nước . Xác định CTHH của A. Biết rằng tỉ khối hơi của A so với khí ôxi là 1,4375.
Do đốt cháy A thu được sản phẩm chứa C, H, O
=> Trong A chứa C, H và có thể có O
Gọi \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{2}{3}a\left(mol\right)\\n_{H_2O}=a\left(mol\right)\end{matrix}\right.\)
\(n_{O_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\)
Theo ĐLBTKL: \(44.\dfrac{2}{3}a+18a=23+1,5.32=71\)
=> a = 1,5 (mol)
=> \(\left\{{}\begin{matrix}n_C=n_{CO_2}=1\left(mol\right)\\n_H=2.n_{H_2O}=3\left(mol\right)\end{matrix}\right.\)
=> \(n_O=\dfrac{23-1.12-3.1}{16}=0,5\left(mol\right)\)
Xét nC : nH : nO = 1 : 3 : 0,5 = 2 : 6 : 1
=> CTPT: (C2H6O)n
Mà MA = 1,4375.32 = 46 (g/mol)
=> n = 1
=> CTPT: C2H6O
\(n_{O_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\\ m_{O_2}=1,5.32=48\left(g\right)\)
Bảo toàn khối lượng: mH2O + mCO2 = mA + mO2 = 23 + 48 = 71 (g)
Ta có:
\(\dfrac{V_{CO_2}}{V_{H_2O}}=\dfrac{2}{3}\Rightarrow\dfrac{n_{CO_2}}{n_{H_2O}}=\dfrac{2}{3}\\ \Rightarrow\dfrac{m_{CO_2}}{m_{H_2O}}=\dfrac{2}{3}.\dfrac{44}{18}=\dfrac{44}{27}\\ \Rightarrow\dfrac{m_{CO_2}}{44}=\dfrac{m_{H_2O}}{27}\)
Theo t/c của dãy tỉ số bằng nhau:
\(\dfrac{m_{CO_2}}{44}=\dfrac{m_{H_2O}}{27}=\dfrac{m_{CO_2}+m_{H_2O}}{44+27}=\dfrac{71}{71}=1\)
=> \(\left\{{}\begin{matrix}m_{CO_2}=1.44=44\left(g\right)\\m_{H_2O}=1.27=27\left(g\right)\end{matrix}\right.\)
Bảo toàn C và H: \(\left\{{}\begin{matrix}n_C=n_{CO_2}=\dfrac{44}{44}=1\left(mol\right)\\n_H=2n_{H_2O}=\dfrac{2.27}{18}=3\left(mol\right)\end{matrix}\right.\)
Bảo toàn O: \(n_O=\dfrac{23-12-3}{16}=0,5\left(mol\right)\)
MA = 1,4375.32 = 46 (g/mol)
CTPT của A có dạng: CxHyOz
=> x : y : z = 1 : 3 : 0,5 = 2 : 6 : 1
=> (C2H6O)n = 46
=> n = 1
=> CTPT của A là C2H6O
Chất hữu cơ A chứa 7,86% H; 15,73% N về khối lượng. Đốt cháy hoàn toàn 2,225 gam A thu được CO2, hơi nước và khí nitơ, trong đó thể tích khí CO2 là 1,68 lít (đktc). Công thức phân tử của A là (biết MA < 100)
A. C3H7ON2
B. C6H14O2N
C. C3H7O2N.
D. C3H7ON
Khi đốt cháy 15g chất A chỉ thu được khí CO2 và hơi nước , tổng thể tích của chúng quy về đktc là 22,4 lít . Tìm CTĐGN của A , CTPT và viết công thức cấu tạo . Biết MA = 30g/mol
Các bạn giải gấp cho mk bài này nha . Mk đang cần rất gấp bạn nào giải đúng mk tick cho
Đặt CTHH của A là CxHyOz
Ta có
CxHyOz+(x+y/4-z/2) O2\(\rightarrow\)xCO2+y/2H2O
nA=\(\frac{15}{12x+y+16z}\)
\(\rightarrow n_{CO2}=\frac{15x}{12x+y+16z}\)
nH2O=7,5y(12x+y+16z)
Ta có
\(\frac{15}{`2z+y+16z}\)+7,5y(12x+y+16z)=1
\(\rightarrow\)3x+6,5y=16z
\(\rightarrow\)x=1 y=2 z=1
\(\rightarrow\)CT đơn giản nhất là CH2O
MA=30 g/mol
\(\rightarrow\)30n=30\(\rightarrow\)n=1
Vậy CTPT là CH2O
CTCT là H-CHO
\(\text{Đốt cháy hoàn toàn 6,8 gam hợp chất A trong oxi không khí (vừa đủ) thì chỉ thu được 14,2 gam }\)\(P_2O_5\) \(và\) \(5,4\) \(gam\) \(hơi\) \(nước\)
a, Tính thể tích không khí đã dùng (đktc), biết oxi chiếm 1/5 thể tích không khí.
b, Hợp chất A có chứa những nguyên tố nào? Vì sao?
c, Xác định công thức đơn giản nhất của hợp chất A.
a, Theo ĐLBT KL, có: mA + mO2 = mP2O5 + mH2O
⇒ mO2 = 14,2 + 5,4 - 6,8 =12,8 (g) \(\Rightarrow n_{O_2}=\dfrac{12,8}{32}=0,4\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,4.22,4=8,96\left(l\right)\)
Mà: O2 chiếm 1/5 thể tích không khí.
\(\Rightarrow V_{kk}=\dfrac{8,96}{\dfrac{1}{5}}=44,8\left(l\right)\)
b, - Đốt A thu P2O5 và H2O → A chứa P và H, có thể có O.
Ta có: \(n_{P_2O_5}=\dfrac{14,2}{142}=0,1\left(mol\right)\Rightarrow n_P=0,1.2=0,2\left(mol\right)\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
⇒ mP + mH = 0,2.31 + 0,6.1 = 6,8 (g) = mA
Vậy: A chỉ có P và H.
c, Gọi CTPT của A là PxHy.
⇒ x:y = 0,2:0,6 = 1:3
→ CTĐGN của A là PH3.
Cho 15,2 gam hỗn hợp chất hữu cơ A phản ứng vừa đủ với 300 ml dung dịch NaOH 1M thu được dung dịch B. Cô cạn dung dịch B chỉ thu được hơi nước 23,6 gam hỗn hợp muối khan C. Đốt cháy hoàn toàn C thu được Na2CO3, 14,56 lít CO2 (đkc) và 6,3 gam H2O. (Biết CTPT của A trùng với CTĐGN). Xác định số đồng phân có thể có của
A. 10
B. 9
C. 7
D. 8
Bảo toàn khối lượng: mX + mNaOH = mmuoi + mH2O
=> mH2O = 15,2 + 40*0,3 - 23,6 = 3,6 => mol H2O = 0,2
mol Na2CO3 = 0,5mol NaOH = 0,15 => mNa2CO3 = 106*0,15 = 15,9 mol CO2 = 14,56/22,4 = 0,65 và mol H2O = 6,3/18 = 0,35
=> mO2 = 44*0,65 + 6,3 + 15,9 - 23,6 = 27,2 => mol O2 = 0,85
CxHyOz + NaOH ---> muối + H2O (1)
a-------------0,3------------------0,2
muối + O2 ----> CO2 + H2O + Na2CO3 (2)
--------0,85-----0,65----0,35-----0,15
Cộng (1), (2):
CxHyOz + NaOH + O2 ----> CO2 + H2O + Na2CO3
a-------------0,3----0,85------0,65---0,55-----0,15
Bảo toàn mol C = ax = 0,65+0,15 = 0,8
Bảo toàn mol H: = ay + 0,3 = 2*0,55 => ay = 0,8
Bảo toàn mol O: az + 0,3 + 2*0,85 = 2*0,65 + 0,55 + 3*0,15 => az = 0,3
ax : ay : az = 0,8 : 0,8 : 0,3 => x : y : z = 8 : 8 : 3 => C8H8O3
Từ đây ta tìm được 8 đồng phân thỏa mãn A
=> Đáp án D
Đốt cháy hoàn toàn 1,88 gam chất hữu cơ A (chứa C, H, O) cần 1,904 lít O2 (đktc) thu được CO2 và hơi nước theo tỉ lệ thể tích 4:3. Hãy xác định công thức phân tử của A. Biết tỉ khối của A so với không khí nhỏ hơn 7.
A. C8H12O5.
B. C4H8O2.
C. C8H42O3.
D. C6H12O6.
Thông thường khi đề bài cho số mol O2 cần để đốt cháy thì chắc chắn ta sẽ phải sử dụng hoặc định luật bảo khối lượng, hoặc bảo toàn nguyên tố Oxi.
Quay trở lại bài toán này, ta thấy đề cho cần dùng 1,904 lít O2, không cho khối lượng CO2 và H2O mà chỉ cho tỉ lệ thể tích (tỉ lệ số mol), do đó nhận ra được nếu ta sử dụng phương pháp bảo toàn khối lượng ta sẽ tính được số mol CO2 và số mol H2O, từ đó tính được số mol O trong A. Tiếp theo đó ta sẽ xác định công thức đơn giản nhất để tìm ra công thức phân tử.
Có: n O 2 = 1 , 904 22 , 4 = 0 , 085 ( m o l ) ⇒ m O 2 = 0 , 085 . 32 = 2 , 72 ( g a m )
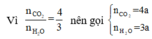
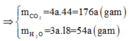
Sơ đồ phản ứng: A + O2 ⇒ CO2 + H2O
Áp dụng định luật bảo toàn khối lượng ta có: m A + m O 2 = m C O 2 + m H 2 O
Hay 1,88 + 2,72 = 176a + 54a ⟺ a = 0,02
⇒ 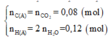
![]()
![]()
Vì C : H : O = nC : nH : nO =0,08 : 0,12 : 0,05 = 8 : 12 : 5
Nên công thức đơn giản nhất của A là C8H12O5.
Khi đó công thức phân tử của A có dạng (C8H12O5)n
Mà MA < 7Mkhôngkhí nên 188n < 7.29 ⇒ n < 1,08 ⇒ n = l
Do đó công thức phân tử của A là C8H12O5.
Đáp án A.
Đốt cháy hoàn toàn 20 ml hơi hợp chất hữu cơ X (chỉ gồm C, H, O) cần vừa đủ 110 ml khí O2, thu được 160 ml hỗn hợp Y gồm khí và hơi. Dẫn Y qua dung dịch H2SO4 đặc (dư), còn lại 80 ml khí Z. Biết các thể tích khí và hơi đo ở cùng điều kiện. Công thức phân tử của X là:
A. C4H10O.
B. C4H8O.
C. C3H8O.
D. C4H8O2.
Ta có
![]()

=> Loại A và C
C4H8Ox + 12 - x 2 O2 → 4CO2 + 4H2O
20 ml 110 ml
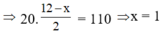
=> X là C4H8O
=> Chọn B.