Khi phân hủy bằng nhiệt 14,2 gam CaC O 3 và MgC O 3 ta thu được 3,36 lít C O 2 ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu lần lượt là:
A. 29,58% và 70,42%
B. 70,42% và 29,58%
C. 65% và 35%
D. 35% và 65%
Khi phân hủy bằng nhiệt 14,2 gam hỗn hợp CaCO3 và MgCO3 ta thu được 6,6 gam CO2 ( ở đktc). Tính thành phần phần trăm các chất trong hỗn hợp.
khi phân hủy bằng nhiệt 14,2 gam hỗn hợp X gồm CaCO3 và MgCO3 ta thu được chất rắn Y gồm CaO và MgO và 6,6 gam CO2. Tính thành phần % khối lượng các chất trong hỗn hợp X.
Gọi số mol CaCO3, MgCO3 là a, b (mol)
=> 100a + 84b = 14,2 (1)
\(n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
PTHH: CaCO3 --to--> CaO + CO2
a-------------------->a
MgCO3 --to--> MgO + CO2
b---------------------->b
=> a + b = 0,15
=> a = 0,1; b = 0,05
=> \(\left\{{}\begin{matrix}\%m_{CaCO_3}=\dfrac{100.0,1}{14,2}.100\%=70,42\%\\\%m_{MgCO_3}=\dfrac{0,05.84}{14,2}.100\%=29,58\%\end{matrix}\right.\)
\(n_{CO_2}=\dfrac{6,6}{44}=0,15mol\)
\(CaCO_3\underrightarrow{t^o}CO_2+CaO\)
\(x\) \(\rightarrow\) \(x\)
\(MgCO_3\underrightarrow{t^o}MgO+CO_2\)
\(y\) \(\rightarrow\) \(y\)
\(\Rightarrow\left\{{}\begin{matrix}100x+84y=14,2\\x+y=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\%m_{CaCO_3}=\dfrac{0,1\cdot100}{14,2}\cdot100\%=70,42\%\)
\(\%m_{MgCO_3}=100\%-70,42\%=29,57\%\)
Khi phân hủy bằng nhiệt 14,2g CaCO3 và MgCO3 ta thu được 3,36 lít CO2 ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu là:
A. 29,58% và 70,42%.
B. 70,42% và 29,58%.
C. 65% và 35%.
D. 35% và 65%
\(n_{CaCO_3}=a\left(mol\right),n_{MgCO_3}=b\left(mol\right)\)
\(m=100a+84b=14.2\left(g\right)\left(1\right)\)
\(n_{CO_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(CaCO_3\underrightarrow{^{^{t^0}}}CaO+CO_2\)
\(MgCO_3\underrightarrow{^{^{t^0}}}MgO+CO_2\)
\(\Rightarrow a+b=0.15\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.05\)
\(\%CaCO_3=\dfrac{0.1\cdot100}{14.2}\cdot100\%=70.42\%\)
\(\%MgCO_3=29.58\%\)
Gọi số mol của \(CaCO_3\) và \(MgCO_3\) lần lượt là x và y => \(^m\)hỗn hợp = PT (1)
Phương trình hóa học:
\(CaCO_3\)→→ \(CaO+CO_2\)
x mol → x mol
\(MgCO_3\) →→ \(MgO+CO_2\)
y mol → y mol
=>\(n_{CO_2}\)=PT (2)
Đáp án là B
Câu 6 : Trong một số điều kiện thích hợp, khi oxi hóa sắt có thể thu được FeO, Fe 2 O 3
hoặc Fe 3 O 4
Khi oxit hóa hoàn toàn 33,6 gam kim loại sắt người ta thu được một oxit sắt có khối
lượng 46,4 gam. Xác định CTHH của oxit sắt ?
Câu 7: Nung 63,2 gam Kalipemanganat sau một thời gian ngừng đun thu được 3,36 lit
khí Oxi ( đktc).
a) Tính phần trăm khối lượng Kalipemanganat bị phân hủy ?
b) Tính thành phần và tổng khối lượng chất rắn thu được sau khi nung ?
giúp mình với mình tick cho10 tick
Nhiệt phân hoàn toàn 14,2 gam hỗn hợp x gồm CaCO³ và MgCO³, thu được 3,36 lít CO² ở đktc. Thành phần phần trăm về khối lượng của CaCO³ trong x là bao nhiêu? Viết PT và giải thích
\(n_{MgCO_3}=x(mol);n_{CaCO_3}=y(mol)\\ \Rightarrow 84x+100y=14,2(1)\\ n_{CO_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ MgCO_3\xrightarrow{t^o}MgO+CO_2\uparrow\\ CaCO_3\xrightarrow{t^o}CaO+CO_2\uparrow\\ \Rightarrow x+y=0,15(2)\\ (1)(2)\Rightarrow x=0,05(mol);y=0,1(mol)\\ \Rightarrow \%_{CaCO_3}=\dfrac{0,1.100}{14,2}.100\%=70,42\%\)
Khi phân huỷ 122,5g KClO3 có xúc tác ở nhiệt độ cao, thể tích khí oxi thu được ở đktc là (K = 39, Cl = 35,5 ; O = 16) A. 33,6 lít B. 3,36 lít C. 11,2 lít D. 1,12 lít
\(pthh:2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\uparrow\)
\(n_{KClO_3}=\dfrac{122,5}{122,5}=1\left(mol\right)\)
Theo pt: \(n_{O_2}=\dfrac{3}{2}.1=1,5\left(mol\right)\)
\(\Rightarrow V_{O_2}=1,5.22,4=33,6\left(lít\right)\)
Chọn A
nKClO3 = 122,5/122,5 = 1 (mol)
PTHH: 2KClO3 -> (t°, MnO2) 2KCl + 3O2
nO2 = 1 : 2 . 3 = 1,5 (mol)
VO2 = 1,5 . 22,4 = 33,6(l)
Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ X ( C, H, O ). Thu được 6,72 lít CO 2 (đktc) và 5,4 gam H 2 O . Khi hóa hơi 1,85 gam X, thu được thể tích bằng với thể tích của 0,7 gam N 2 cùng nhiệt độ, áp suất. Xác định công thức phân tử của X
A. C 5 H 10 O
B. C 3 H 6 O 2
C. C 2 H 2 O 3
D. C 3 H 6 O
Đáp án B
Đặt CTPT của X là CxHyOz
Do ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cũng chính là tỉ lệ về số mol.
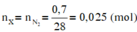
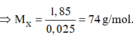

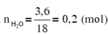
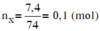
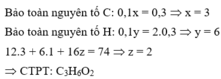
Câu 1. CaO có ba zơ tương ứng là
A. CaCO3 B. CaSO4 C. Ca(OH)2 D. CaCl2
Câu 2. Khi phân hủy xúc tác 12,25 gam KClO3 thể tích oxi thu được ở đktc là
A. 3,36 lít B. 33,6 lít C. 6,72 lít D. 67,2 lít
a) Nhiệt phân m gam KMnO4 thu được 11,2 lít khí oxi (đktc). Tính m. (K = 39; Mn = 55; O = 16)
b) Khử hoàn toàn 80 gam Fe2O3 bằng V lít (đktc) khí hiđro ở nhiệt độ cao. Tính V. ( Fe = 56; O = 16)
c) Cho 8 gam bột CuO tác dụng với 1,12 lít khí H2 (đktc) ở nhiệt độ cao. (O = 16; Cu = 64)
- Chất nào còn dư sau phản ứng và dư là bao nhiêu mol?
- Tính khối lượng chất rắn và thể tích chất khí (đktc) thu được sau phản ứng.
a) \(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
1<-----------------------------0,5
=> \(m_{KMnO_4}=1.158=158\left(g\right)\)
b) \(n_{Fe_2O_3}=\dfrac{80}{160}=0,5\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,5--->1,5
=> \(V_{H_2}=1,5.22,4=33,6\left(l\right)\)
c) \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,05<-0,05---->0,05-->0,05
=> \(n_{Cu\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
mCu = 0,05.64 = 3,2 (g)
VH2O = 0,05.22,4 = 1,12 (l)
a)\(n_{O_2}=\dfrac{11,2}{22,4}=0,5mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
1 0,5
\(M_{KMnO_4}=1\cdot158=158g\)
b)\(n_{Fe_2O_3}=\dfrac{80}{160}=0,5mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,5 1,5
\(V_{H_2}=1,15\cdot22,4=25,76l\)