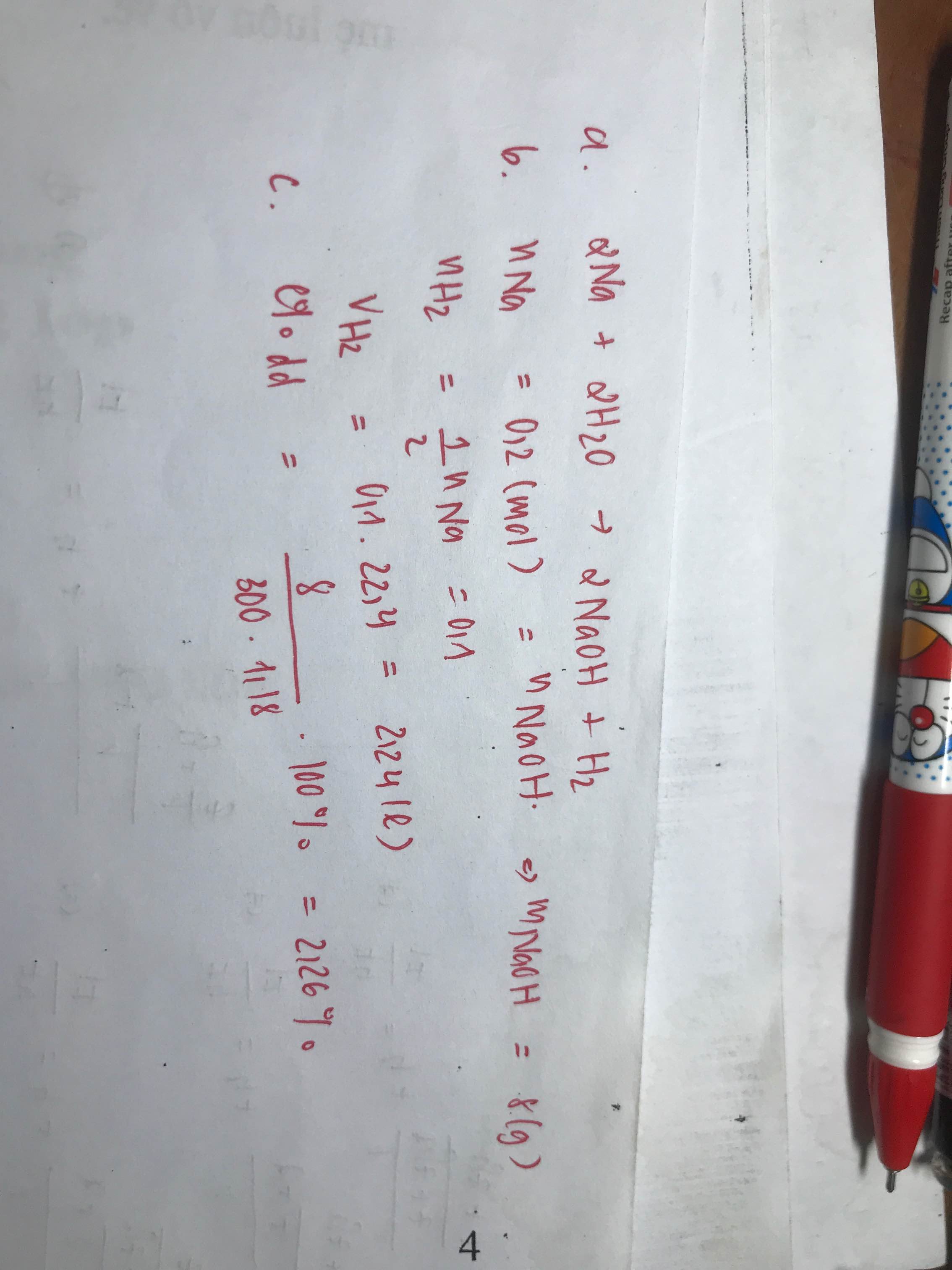Đốt cháy hoàn toàn 4,6g Natri rồi lấy sản phẩm cho vào 120g dd NaOH 25% thu được dd X. Tính C% dd X

Những câu hỏi liên quan
đốt cháy hoàn toàn 4,6g Na rồi lấy sản phẩm cho vào bình chưa 200g H2O thu đc dd A. Nồng độ % dd A là?
nNa = 4,6 / 23 = 0,2 (mol)
Na + 2H2O -- > NaOH + H2
mH2 = 0,2.2 =0,4 (g)
dd = mNa + mddH2O - mH2 = 4,6 + 200 - 0,4 = 204,2(g)
mNaOH = 0,2 . 40 = 8(g)
=> \(C\%_{ddA}=\dfrac{8.100}{204,2}=3,9\%\)
Đúng 5
Bình luận (0)
Đốt cháy hoàn toàn hỗn hợp X (C,S) rồi dẫn sản phẩm cháy vào bình đượng 11,2g dd NaOH 25% thấy khối lượng của bình tăng lên 1,3g, khi phản ứng kết thúc cô cạn dung dịch thu được thấy có 3,65g chất rắn. Xác định % khối lượng các chất trong X
Đối cháy hoàn toàn 4,6g Natri rồi lấy sản phẩm hòa tan vào 400ml dd NaOH 0,5M , thu được dd A. Tính CM dd A
đốt cháy hoàn toàn 3,86 gam một hỗn hợp gồm ancol etulic và benzen. Cho sản phẩm dốt cháy hấp thụ hoàn toàn vào 500ml dd NAOH 0,8 M thu được dd Y. Thêm một lượng dư CaCl2 vào dd Y tạo ra 18 gam kết tủa. Tính thành phần % khối lượng ancol etylic và benzen trong hh ban đầu
Đốt cháy hoàn toàn 672ml etillen(đkt) trong oxi rồi dẫn sản phẩm khí vào 250ml dd NaOH 0,2M.Tính khối lượng muối thu đc
\(n_{C_2H_4}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: \(C_2H_4+3O_2\xrightarrow[]{t^o}2CO_2+2H_2O\)
0,03-------------->0,06
\(n_{NaOH}=0,25.0,2=0,05\left(mol\right)\)
Xét \(T=\dfrac{0,05}{0,06}=\dfrac{5}{6}\) => Tạo muối NaHCO3 và CO2 dư
PTHH: \(NaOH+CO_2\rightarrow NaHCO_3\)
0,05---------------->0,05
\(\rightarrow m_{muối}=0,05.84=4,2\left(g\right)\)
Đúng 2
Bình luận (0)
Câu 1.1:Đốt cháy hoàn toàn 0,3mol hỗn hợp X gồm CH4,C2H4 và C2H2 hấp thụ toàn bộ sản phẩm cháy vào 650ml dd NaOH 1M thì thu đc dd Y.Biết Y chứa 42,2gam hỗn hợp muối và khối lượng Y nặng hơn khối lượng dd NaOH ban đầu là 29,7gam.Tính phần trăm thể tích CH4 trong X.Câu 1.2:Đốt cháy hoàn toàn 12,769 lít (đktc) hỗn hợp khí A gồm metan,propan(CH3-CH2-CH3),etilenvafbut-2-en(CH3-CHCH-CH3)cần vừa đủ 54,88 lít(đktc)O2.Mặt khác 12,768 lít(đktc) hỗn hợp khí A có khả năng làm mất màu tối đa 700ml dd Br2 0,5...
Đọc tiếp
Câu 1.1:Đốt cháy hoàn toàn 0,3mol hỗn hợp X gồm CH4,C2H4 và C2H2 hấp thụ toàn bộ sản phẩm cháy vào 650ml dd NaOH 1M thì thu đc dd Y.Biết Y chứa 42,2gam hỗn hợp muối và khối lượng Y nặng hơn khối lượng dd NaOH ban đầu là 29,7gam.Tính phần trăm thể tích CH4 trong X.
Câu 1.2:Đốt cháy hoàn toàn 12,769 lít (đktc) hỗn hợp khí A gồm metan,propan(CH3-CH2-CH3),etilenvafbut-2-en(CH3-CH=CH-CH3)cần vừa đủ 54,88 lít(đktc)O2.Mặt khác 12,768 lít(đktc) hỗn hợp khí A có khả năng làm mất màu tối đa 700ml dd Br2 0,5M.Tính khối lượng của 12,768 lít(đktc) hỗn hợp khí A
Câu 1.1 : Muối gồm NaHCO3(y mol) ; n Na2CO3(x mol)
Ta có :
106x + 84y = 42,2
2x + y = 0,65.2
=> x = 0,2 ; y = 0,25
=> n CO2 = x + y = 0,45(mol)
m H2O = 29,7 - 0,45.44 = 9,9(gam)
n H2O = 9,9/18 = 0,55(mol)
Gọi n CH4 = a(mol) ; n C2H4 = b(mol) ; n C2H2 = c(mol)
Ta có:
a + b + c = 0,3
a + 2b + 2c = 0,45
2a + 2b + c = 0,55
=> a = 0,15 ; b = 0,1 ; c = 0,05
%V CH4 = 0,15/0,3 .100% = 50%
Đúng 1
Bình luận (0)
n CH4 = a(mol) ; n C3H8= b(mol) ; n C4H8 = c(mol)
=> a + b = c = 12,769/22,4 = 0,57(mol) (1)
Bảo toàn e :
8a +20b + 24c = 4n O2 = 4.54,88/22,4 = 9,8 (2)
n Br2 = c = 0,7.0,5 = 0,35(3)
Từ (1)(2)(3) => a = 0,25 ; b = -0,03 <0
=> Sai đề
Đúng 2
Bình luận (0)
baif1: số ml dd NaOH 1M trộn lẫn với 50ml dd H3PO4 1M để thu được muối trung hòa làbài 2: cho 142g P2O5 vào 500g dd H3PO4 23,72% được dd A. Nồng đọ H3PO4 trong dung dịch A là bao nhiêubài 3: Đốt cháy hoàn toàn 6,2g photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dd NaOH 32%, thu được muối Na2HPO4. giá trị m làbài 4 cho 14,2g P2O5 vào 200g dd NaOH 8% thu được dd A. Muối thu được và nồng độ % tương ứng là
Đọc tiếp
baif1: số ml dd NaOH 1M trộn lẫn với 50ml dd H3PO4 1M để thu được muối trung hòa là
bài 2: cho 142g P2O5 vào 500g dd H3PO4 23,72% được dd A. Nồng đọ H3PO4 trong dung dịch A là bao nhiêu
bài 3: Đốt cháy hoàn toàn 6,2g photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dd NaOH 32%, thu được muối Na2HPO4. giá trị m là
bài 4 cho 14,2g P2O5 vào 200g dd NaOH 8% thu được dd A. Muối thu được và nồng độ % tương ứng là
bài 1
nH3PO4 = 0,05
3NaOH + H3PO4 => Na3PO4 +3 H2O
0,15 <-------0,05
=> V NaOH = 0,15/1=0,15l - 150ml
Đúng 0
Bình luận (1)
bài 2
coi P2O5 là dd
=> trong P2O5 C% H3PO4 = \(\frac{98.2}{142}\) = 138%
142 138 X- 23,72
X
500 23,72 138- X
=> \(\frac{X-23,72}{138-X}\) = \(\frac{142}{500}\) => X = 49%
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Hòa tan hoàn toàn 4,6g Natri vào nước thu được 300ml dd NaOH
a. Viết phương trình của phản ứng
b. Tính thể tích khí hidro tạo thành ở đktc
c. Tính nồng độ % của dd NaOH thu đc sau phản ứng
\(n_{Na}=\dfrac{4,6}{23}=0,2mol\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,2 0,2 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{NaOH}=0,2\cdot40=8g\)
\(m_{ddNaOH}=4,6+0,2\cdot18-0,1\cdot2=8g\)
\(\Rightarrow C\%=\dfrac{m_{NaOH}}{m_{ddNaOH}}\cdot100\%=\dfrac{8}{8}\cdot100\%=100\%???\)
Sửa đề: Tính nồng độ mol của dung dịch NaOH???
\(C_{M_{NaOH}}=\dfrac{0,2}{0,3}=\dfrac{2}{3}M\)
Đúng 4
Bình luận (0)
vì đề không cho \(D_{NaOH}=???\) nên không tính được dung dịch NaOH
Đúng 1
Bình luận (1)
Xem thêm câu trả lời
Cho 7,6g hỗn hợp X gồm CH4 và C2H4 ( tỉ lệ thể tích \(V_{CH4}:V_{C2H4}\)= 5:8), đốt cháy hoàn toàn hỗn hợp X rồi dẫn sản phẩm vào dd chứa 29,6g \(Ca\left(OH\right)_2\) . Hỏi khối lượng dd thu dc tăng hay giảm bao nhiêu gam so với khối lượng dd Ca(OH)2 ban đầu?
Giả sử: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_4}=y\left(mol\right)\end{matrix}\right.\)
⇒ 16x + 28y = 7,6 (1)
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ thể tích cũng là tỉ lệ số mol.
Ta có: \(\dfrac{V_{CH_4}}{V_{C_2H_4}}=\dfrac{5}{8}\Rightarrow\dfrac{n_{CH_4}}{n_{C_2H_4}}=\dfrac{x}{y}=\dfrac{5}{8}\)
\(\Rightarrow x=\dfrac{5}{8}y\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,125\left(mol\right)=n_{CH_4}\\y=0,2\left(mol\right)=n_{C_2H_4}\end{matrix}\right.\)
BTNT C và H, có: \(\left\{{}\begin{matrix}n_{CO_2}=n_{CH_4}+2n_{C_2H_4}=0,525\left(mol\right)\\n_{H_2O}=\dfrac{4n_{CH_4}+4n_{C_2H_4}}{2}=0,65\left(mol\right)\end{matrix}\right.\)
Ta có: \(n_{OH^-}=2n_{Ca\left(OH\right)_2}=0,8\left(mol\right)\)
\(\Rightarrow\dfrac{n_{OH^-}}{n_{CO_2}}=\dfrac{0,8}{0,525}\approx1,5\)
⇒ Pư tạo CaCO3 và Ca(HCO3)2.
Giả sử: \(\left\{{}\begin{matrix}n_{CaCO_3}=a\left(mol\right)\\n_{Ca\left(HCO_3\right)_2}=b\left(mol\right)\end{matrix}\right.\)
BTNT Ca và C, có: \(\left\{{}\begin{matrix}a+b=0,525\\a+2b=0,8\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,25\left(mol\right)\\b=0,275\left(mol\right)\end{matrix}\right.\)
Có: m thêm vào dd = mCO2 + mH2O = 34,8 (gam)
Mà: m↓ = mCaCO3 = 0,25.100 = 25 (g)
Vậy: Dung dịch thu được tăng và tăng: 34,8 - 25 = 9,8 (g)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)