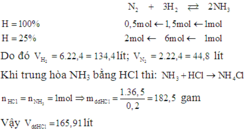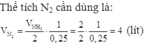Để điều chế được 1700g NH3 thì phải dùng một lượng N2 và H2 là bao nhiêu biết hiệu suất phản ứng là 25%

Những câu hỏi liên quan
Để điều chế được 1700g NH3 thì phải dùng một lượng N2 và H2 là bao nhiêu biết hiệu suất phản ứng là 25%
Để điều chế được 1700g NH3 thì phải dùng một lượng N2 và H2 là bao nhiêu biết hiệu suất phản ứng là 25%
Ta có:
\(n_{NH3}=\frac{1700}{17}=100\left(mol\right)\)
\(PTHH:N_2+3H_2\underrightarrow{^{t^o}}2NH_3\)
________50 ____150 __ 100____
\(n_{N2}=\frac{50}{H}=\frac{50}{25\%}=200\left(mol\right)\)
\(\Rightarrow m_{N2}=200.28=5600\left(g\right)\)
\(n_{H2}=\frac{150}{H}=\frac{150}{25\%}=600\left(mol\right)\Rightarrow m_{H2}=600.2=1200\left(g\right)\)
Vậy cần dùng 5600g N2 và 1200g H2
Đúng 0
Bình luận (0)
Phải dùng bao nhiêu lít N2 và H2 (đktc) để điều chế 17 gam NH3. Biết hiệu suất chuyển hoán thành NH3 là 25%. Nếu dùng dung dịch HCl 20% (d 1,1g/ml) để trung hòa lượng NH3 trên thì cần bao nhiêu ml? A. 165,91 lít B. 163 lít C. 175,91 lít D. 153 lít
Đọc tiếp
Phải dùng bao nhiêu lít N2 và H2 (đktc) để điều chế 17 gam NH3. Biết hiệu suất chuyển hoán thành NH3 là 25%. Nếu dùng dung dịch HCl 20% (d = 1,1g/ml) để trung hòa lượng NH3 trên thì cần bao nhiêu ml?
A. 165,91 lít
B. 163 lít
C. 175,91 lít
D. 153 lít
Tính thể tích khí N2 và khí H2 (đktc) cần dùng để điều chế được 17 gam NH3. Biết hiệu suất phản ứng là 25%.
Vì hiệu suất là 25%
=> \(m_{NH_3}=17.\dfrac{25\%}{100\%}=4,25\left(g\right)\)
Ta có: \(n_{NH_3}=\dfrac{4,25}{17}=0,25\left(mol\right)\)
PTHH: N2 + 3H2 ---> 2NH3
Theo PT: \(n_{H_2}=\dfrac{3}{2}.n_{NH_3}=\dfrac{3}{2}.0,25=0,375\left(mol\right)\)
=> \(V_{H_2}=0,375.22,4=8,4\left(lít\right)\)
Theo PT: \(n_{N_2}=\dfrac{1}{2}.n_{NH_3}=\dfrac{1}{2}.0,25=0,125\left(mol\right)\)
=> \(V_{N_2}=0,125.22,4=2,8\left(lít\right)\)
Đúng 0
Bình luận (0)
\(n_{NH_3}=1\left(mol\right)\)
Bảo toàn nguyên tố:
\(\left\{{}\begin{matrix}n_{N_2}=\dfrac{n_{NH_3}}{2}=0,5\left(mol\right)\\n_{H_2}=\dfrac{3n_{NH_3}}{2}=1,5\left(mol\right)\end{matrix}\right.\)
Do hiệu suất 25% \(\Rightarrow\left\{{}\begin{matrix}n_{N_2}=2\left(mol\right)\\n_{H_2}=6\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}V_{N_2}=44,8\left(l\right)\\n_{H_2}=134,4\left(l\right)\end{matrix}\right.\)
Đúng 0
Bình luận (2)
Cần lấy bao nhiêu lít N2 và H2 để điều chế được 4,48 lít NH3, biết hiệu suất phản ứng là 20%. Các khí được đo ở đktc
PTHH:3H2+N2=2NH3
nNH3=0,2(mol) suy ra nH2=0,3(mol);nN2=0,1(mol)
suy ra V H2=6,72(l);V N2=2,24(l)
mà hiệu suất phản ứng chỉ có 20 phần trăm
suy ra V H2 cần dùng để điều chế 4,48 lít NH3 là:6,72x100:20=3,36(l)
V N2 cần dùng để điều chế 4,48 lít NH3 là:2,24x100:20=11,2(l)
Đúng 0
Bình luận (0)
Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hidro để điều chế 17 gam NH3, biết rằng hiệu suất chuyển hóa thành amoniac là 25%. Các thể tích khí đo được ở đktc.
A. 44,8 lít N2 và 13,44 lít H2.
B. 22,4 lít N2 và 134,4 lít H2.
C. 22,4 lít N2 và 67,2 lít H2.
D. 44,8 lít N2 và 67,2 lít H2.
$n_{NH_3} = \dfrac{17}{17} = 1(mol)$
$N_2 + 3H_2 \xrightarrow{t^o} 2NH_3$
Theo PTHH :
$n_{N_2\ pư} = \dfrac{1}{2}n_{NH_3} = 0,5(mol)$
$n_{H_2\ pư} = \dfrac{3}{2}n_{NH_3} = 1,5(mol)$
Suy ra :
$n_{N_2\ đã\ dùng} = \dfrac{0,5}{25\%} = 2(mol)$
$n_{H_2\ đã\ dùng} = \dfrac{1,5}{25\%} = 6(mol)$
Vậy :
$V_{N_2} = 2.22,4 = 44,8(lít)$
$V_{H_2} = 6.22,4 = 134,4(lít)$
Đúng 1
Bình luận (0)
Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro để điều chế 17,00 gram NH3. Biết rằng hiệu suất chuyển hoá thành amoniac là 25%. Các thể tích khí được đo ở đktc. A. 44,8 lit N2 và 134,4 lit H2 B. 22,4 lit N2 và 134,4 lit H2 C. 22,4 lit N2 và 67,2 lit H2 D. 44,8 lit N2 và 67,2 lit H2
Đọc tiếp
Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro để điều chế 17,00 gram NH3. Biết rằng hiệu suất chuyển hoá thành amoniac là 25%. Các thể tích khí được đo ở đktc.
A. 44,8 lit N2 và 134,4 lit H2
B. 22,4 lit N2 và 134,4 lit H2
C. 22,4 lit N2 và 67,2 lit H2
D. 44,8 lit N2 và 67,2 lit H2
- Đáp án A
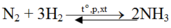
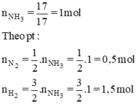
Do hiệu suất 25% nên
nN2cần dùng = 2( mol) và nH2cần dùng = 6(mol).
⇒VN2 = 2. 22,4 = 44,8 (lit) và VH2 = 22,4. 6= 134,4 (lit).
Đúng 1
Bình luận (0)
Để điều chế 4 lít NH3 từ N2 và H2 với hiệu suất 50% thì thể tích H2 cần dùng ở điều kiện là bao nhiêu?
A. 4 lít
B. 6 lít
C. 8 lít
D. 12 lít
Đáp án D
N2 + 3H2![]() 2NH3
2NH3
Theo PT VH2=3/2VNH3= 6 lít
Do hiệu suất 50% nên:
VH2 thực tế= 100. VH2/50= 100.6/50= 12 lít
Đúng 0
Bình luận (0)
Để điều chế 2 lít NH3 từ N2 và H2 với hiệu suất 25% thì thể tích N2 cần dùng ở cùng điều kiện là:
A. 8 lít
B. 2 lít
C. 4 lít
D. 1 lít