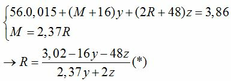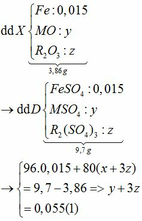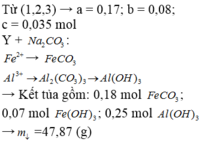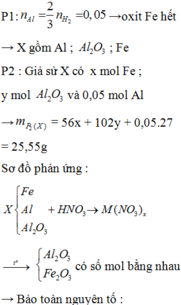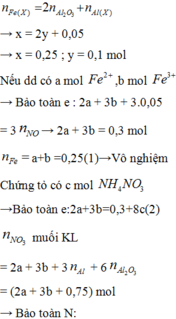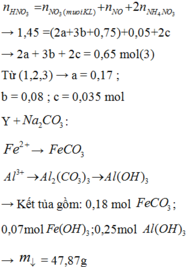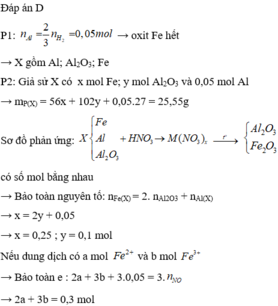Hòa tan hoàn toàn hỗn hợp gồm MgO, Zn(OH)2, Al, FeCO3, Cu(OH)2, Fe trong dung dịch H2SO4 loãng dư, sau phản ứng thu được dung dịch X. Cho vào dung dịch X một lượng Ba(OH)2 dư thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi được hỗn hợp rắn Z, sau đó dẫn luồng khí CO dư (ở nhiệt độ cao) từ từ đi qua Z đến khi phản ứng xảy ra hoàn toàn thu được chất rắn G. Thành phần các chất trong G là A. MgO, BaSO4, Fe, Cu B. BaO, Fe, Cu, Mg, Al2O3 C. MgO, Al2O3, Fe, Cu, ZnO D. BaSO4, MgO,...
Đọc tiếp
Hòa tan hoàn toàn hỗn hợp gồm MgO, Zn(OH)2, Al, FeCO3, Cu(OH)2, Fe trong dung dịch H2SO4 loãng dư, sau phản ứng thu được dung dịch X. Cho vào dung dịch X một lượng Ba(OH)2 dư thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi được hỗn hợp rắn Z, sau đó dẫn luồng khí CO dư (ở nhiệt độ cao) từ từ đi qua Z đến khi phản ứng xảy ra hoàn toàn thu được chất rắn G. Thành phần các chất trong G là
A. MgO, BaSO4, Fe, Cu
B. BaO, Fe, Cu, Mg, Al2O3
C. MgO, Al2O3, Fe, Cu, ZnO
D. BaSO4, MgO, Zn, Fe, Cu