Cho 1,96g bột sắt vào 100ml dd CuSO4 10% có khối lượng riêng là 1,12g/ml
a.viết PTPỨ
b.xác định nồng độ mol/lit của các chất trong dd sau khi PỨ kết thúc
c.cô cạn dd thu được bao nhiêu gam muối khan
Cho 3,2 gam bột sắt vào 100ml dd CuSo4 10% có khối lượng riêng là 1,12g/ml.
a) Viết phương trình phản ứng hóa học
b) Xác định nồng độ mol của các chất trong dd thu được sau phản ứng. Giả thiết thể tích dung dịch thay đổi không đáng kể
Cho 18.5 gam hỗn hợp X gồm Fe, Zn, Cu vào dung dịch H2SO4 loãng dư thu được 4,48 lit khí (dktc). Nếu cũng cho lượng hỗn hợp X trên vào H2SO4 đặc nóng, eư thì thu được 7,84 lit khí SO2 (dktc)
a) Tính thành phần trăm theo khối lượng của các kim loại trong hỗn hợp đầu
b) Dẫn lượng khí So2 thu được đi qua 200ml dd KOH 1M. Tính khối lượng và nồng độ mol các chất trong dd sau phản ứng
Cho 6.048 g Mg phản ứng hết với 189 g dd HNO3 40% thu được dd X ( không chứa muối) amoni và hỗn hợp hkí là oxjt của njtơ.thêm 392 g dd KOH 20% vào dd X, rồi cô cạn và nung sản phẩm đến khối lượng ko đổi thu được 118,06 g hỗn hợp chất rắn. Hãy xác định nồn độ % của các chất trong X
nMg = 0,252, nHNO3 = 1,2 & nKOH = 1,4
Vậy KOH dư, Mg2+ đã kết tủa hết, phần dung dịch chứa KNO3 & KOH dư, phần kết tủa chứa Mg(OH)2, cô cạn và nung thu được KNO2 & KOH dư & MgO
nKOH ban đầu = nKNO2 + nKOH dư = 1,4
m rắn = 85nKNO2 + 56nKOH dư + 40.0,252 = 118,06
—> nKNO2 = 1,02 & nKOH dư = 0,38
Bảo toàn N —> nN trong khí = nHNO3 – nKNO3 = 0,18
Vậy mỗi N+5 đã nhận 0,252.2/0,18 = 2,8 mol electron
—> Số oxi hóa trung bình của N = 5 – 2,8 = +2,2
—> Oxit trung bình NO1,1 (0,18 mol)
nHNO3 pư = 0,252.2 + 0,18 = 0,684
—> nHNO3 dư = 0,516
mdd = mMg + mddHNO3 – mNO1,1 = 189,36
—> C% HNO3 dư & C% Mg(NO3)2
nguyên tắc để sản xuất gang ,thép trong luyện kim là PỨ khử oxit sắt trong quặng sắt thành sắt:
a.khối lượng sắt khi khử hoàn toàn 4,64g Fe2SO4
b.hòa lượng sắt thu được vào 500ml dd H2SO4 loãng có nồng độ 0,1M. Sau khi PỨ xảy ra hoàn toàn, thì chất nào hết, chất nào dư
-tính thể tích khí thoát ra(đktc)
-tính nồng độ mol/lit của các chất còn lại sau PỨ
-cô cạn dd thu được bao nhiêu gam muối khan
Fe3O4 mới đúng nhé.không phải Fe2SO4
a,\(Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\)
\(n_{Fe3O4}=\frac{4,64}{232}=0,02\left(mol\right)\)
\(\Rightarrow n_{Fe}=0,06\left(mol\right)\)
\(m_{Fe}=0,06.56=3,36\left(g\right)\)
b,\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(n_{H2SO4}=0,05.0,1=0,05\left(mol\right)\)
Tỉ lệ: \(\frac{0,06}{1}>\frac{0,05}{1}\)
Nên Fe dư
\(n_{Fe\left(dư\right)}=0,06-0,05=0,01\left(mol\right)\)
\(m_{Fe\left(dư\right)}=0,01.56=0,56\left(g\right)\)
\(n_{H2}=n_{H2SO4}=0,05\left(mol\right)\)
\(V_{H2}=0,05.22,4=1,12\left(l\right)\)
\(CM_{FeSO4}=\frac{0,05}{0,5}=0,1M\)
\(m_{FeSO4}=0,05.152=7,6\left(g\right)\)
Ngâm 1 lá Fe có khỏi lượng 2,5g trong 25ml dd CuSO4 15% có khối lượng riêng là 1,12g/ml. Sau 1 thời gian PỨ. Người ta lấy lá sắt ấy ra khỏi dd và làm khô thì cân nặng là 2,85g
a.Viết PTPỨ
b.Tính nồng độ % của dd sau PỨ
a)
Fe + CuSO4 → FeSO4 + Cu
x___ x______ x________x mol
m tăng = 2,58 - 2,5 = 0,08 gam.
Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b)nCuSO4 ban đầu : 25.1,12.15/100.160= 0,02625 mol
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = 0,016250.160/27,91.100% ≈ 9,32%
C%, FeSO4 =0,01.152/27,91 .100% ≈ 5,45%
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu 25.1,12.15/100.160= 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = 0,016250.160/27,91.100% ≈ 9,32%
C%, FeSO4 =0,01.152/27,91 .100% ≈ 5,45%
Cho 2,7 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau một thời gian, thu được dung dịch Y và 2,84 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 (loãng, dư). Sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là:
A. 58,52%
B. 51,85%
C. 48,15%
D. 41,48%
Đáp án B
Zn có tính khử mạnh hơn Fe, Zn sẽ phản ứng với dung dịch CuSO4 trước.
Theo đề: hỗn hợp rắn Z phản ứng với dung dịch H2SO4 loãng thu được 1 muối duy nhất → trong hỗn hợp rắn Z có Cu và Fe dư. Vậy mFe dư = 0,28 (g) và mCu = 2,84 - 0,28 = 2,56 (g)
Ta có: khối lượng hỗn hợp X phản ứng với Cu2+ = 2,7 - 0,28 = 2,42 (g)
Gọi nZn = x mol; nFe pư = y mol
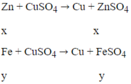
Ta có hệ:
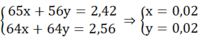
mFe ban đầu = 0,02.56 + 0,28 = 1,4 (g)
![]()
1.cho dd chua 100 ml dd AgNO3 1M tac dung hoan toan voi 200 ml dd NaCl 1M
a. Tinh khôi lượng kết tủa tạo thành
b. Tinh nồng độ mol/lit cua các chất trong dd tạo thành.
2, cho 2.74 g Ba hoa tan hoan toan vao H2O tao thanh dd X .
a. Tinh khoi luong H2 tao thanh
b. Cho dd X pứ voi dd H2SO4 dư. Tinh so gam ket tủa tao thanh.
3, Cho m gam (sắt ôxit) FeO tác dụng hết với 600ml dd HCl (axit clohidric) đặc tạo thành dd (sắt clorua) FeCl2 0,2M. Tính m?
Cho 10g hỗn hợp Fe và Cu vào dd CuSO4 dư. Sau khi phản ứng xong thu được chất rắn có khối lượng là 11g , tính thành phần % theo khối lượng của Fe và Cu trong hỗn hợp đầu
HELPPP MEEEE- Đề thi Hsg cơ mà mình hs dốt nátttttt~.~""
1 ,Hòa tan 6.02 g hỗn hợp Na và Na2O vào m g H2O được 200 g dd A. Cô cạn dd A thu được 8,8 g chất rắn khan
a, tính thành phần % mỗi chất trong hỗn hợp?
b, m=?
2 ,Để hòa tan 32 g oxit của 1 kim loại R(III) cần dùng 168 g dd H2SO4 35%
a, Kim loại R
b, C% của chất tan trong dd sau PỨ
c, m của tinh thể R2(SO4)3.10H2O tạo được khi làn khan dd trên
3, Hòa tan hoàn toàn hỗn hợp A gồn Cu, Mg vào 1 lượng vừa đủ dd H2SO4 70% đặc,nóng thu đc 1,12 l khí SO2(đktc) và dd B. Chia B thành 2 phần bằng nhau. Cho 1 phần tác dụng vs NaOH dư, lọc kết tủa, nung đến khi khối lượng k đổi đc 1,6 g chất rắn C.
a, viết PTHH
b, m mỗi kim loại trong A
c, thêm 3,4 g H2O vào 2 phần đc dd B. C% cua các chất trong B
Bạn nào có tâm dạy mình vssss
Thankssss!!!!