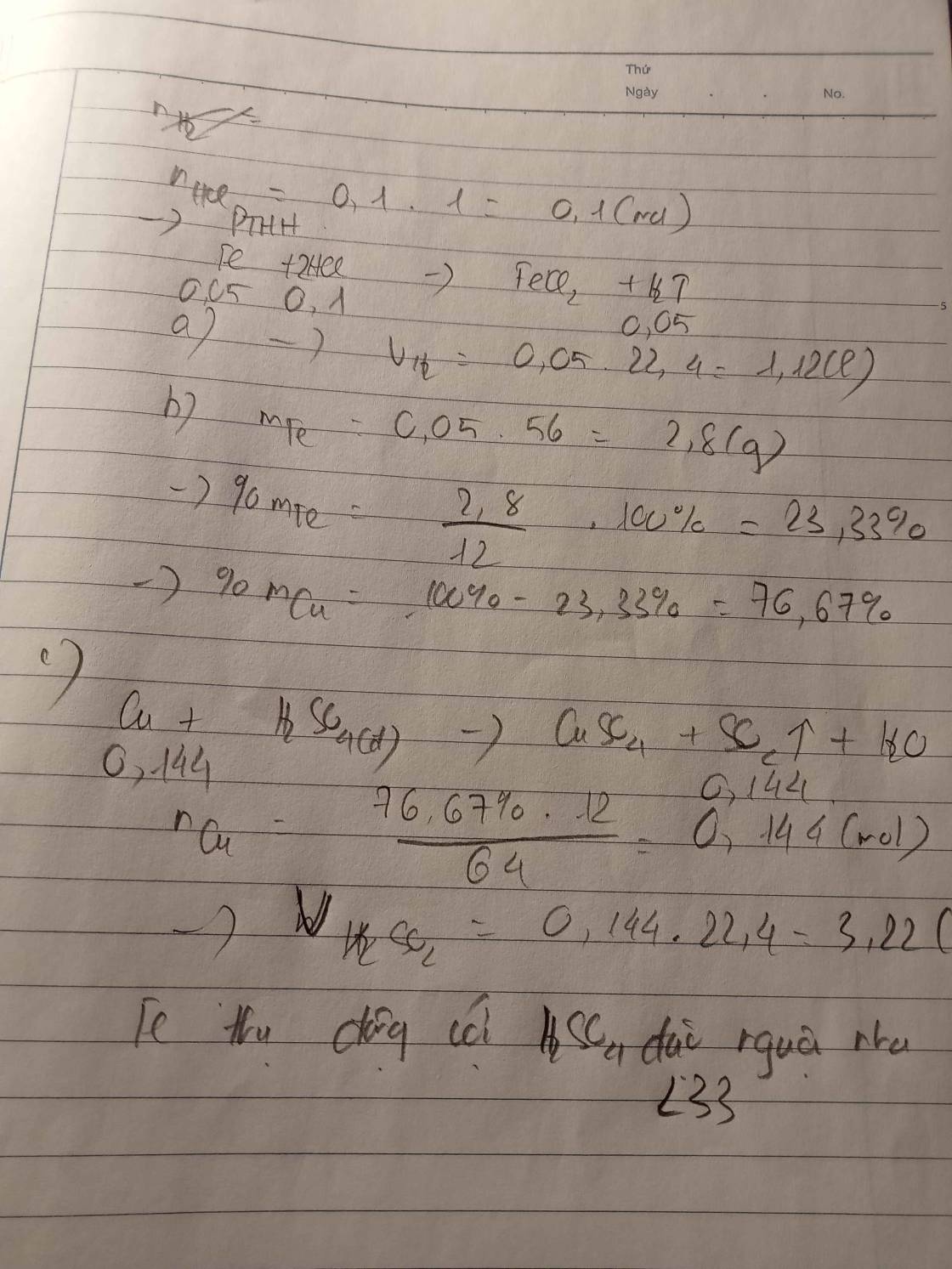Cho 12g hỗn hợp : Fe&Cu 400ml dd HCl vừa đủ sau p/ứ thu đc 2,24(l)khí H2 (đktc) . Tính thành phần % theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu

Những câu hỏi liên quan
Cho 12g hỗn hợp A gồm Fe và Cu tác dụng với một lượng vừa đủ 100ml dung dịch HCl 1M. a. Tính thể tích H2 thoát ra ở điều kiện tiêu chuẩn. b. Tính phần trăm mỗi kim loại trong hỗn hợp ban đầu. c. Nếu cho 12g hỗn hợp A tác dụng với dùng dịch H2SO4 đặc dư thì thể tích khí SO2 ở điều kiện tiêu chuẩn thu được là bao nhiêu?
Cho m(g) Fe vào oxi thu dc 12g hỗn hợp gồm Fe,FeO,Fe2O3 . cho hỗn hợp này tác dụng với HNO3 dc 2,24l NO . Tính m
Cho 12g hỗn hợp A gồm Fe và kim loại M (hóa trị 2 không đổi) vào dung dịch HCl dư thu được 2,24l H2 (đ.k.t.c). Mặt khác khi cho 12g hỗn hợp A ở trên tác dụng hết với khí Cl2 ở nhiệt độ cao thì thấy lượng Cl2 phản ứng tối đa là 5,6l (đ.k.t.c). Biết sản phẩm tạo ra là FeCl3 và MCl2. Biết rằng các phản ứng xảy ra hoàn toàn. Xác định kim loại M
nH2=0,1(mol)
nCl2=0,25(mol)
Gọi a, b là số mol Fe và M.
- TN2:
2Fe+3Cl2→2FeCl32Fe+3Cl2→2FeCl3
M+Cl2→MCl2+H2M+Cl2→MCl2+H2
⇒1,5a+b=0,25⇒1,5a+b=0,25 (1)
- TN1:
+ Nếu M>H:
Fe+2HCl→FeCl2+H2Fe+2HCl→FeCl2+H2
M+2HCl→MCl2+H2M+2HCl→MCl2+H2
⇒a+b=0,1⇒a+b=0,1 (2)
(1)(2)⇒a=0,3;b=−0,2⇒a=0,3;b=−0,2 (loại)
+ Nếu M<H:
⇒a=0,1⇒a=0,1 (3)
(1)(3)⇒b=0,1⇒b=0,1
mhh=12g⇒56.0,1+0,1M=12mhh=12g⇒56.0,1+0,1M=12
⇔M=64(Cu)
Đúng 0
Bình luận (0)
Cho 8g hỗn hợp Mg và Fe tác dụng vừa đủ với V(l) khí O2 (đktc).Thu được 12g hỗn hợp các loại ô-xit .Tìm V và % mỗi loại khí??????
gọi a, là số mol của Mg và Fe
PTHH: 2Mg+O2=>2MgO
a------a/2------>a
2Fe+O2=>2FeO
b--------b/2----->b
theo đề ta có hpt: \(\begin{cases}40a+68b=12\\24a+56b=8\end{cases}\)
<=>\(\begin{cases}a=\frac{4}{19}\\b=\frac{1}{19}\end{cases}\)
=> V=(4/19+1/19).22,4=5,9ml
mMg=4/19.24=5,1g
=> %Mg=\(\frac{5,1}{8}.100=63,75\%\)
%Fe=100-63,75=36,25%
Đúng 0
Bình luận (0)
cho 12g hỗn hợp A gồm 2 kim loại Cu và Fe tác dụng hoàn toàn với axit HCl thu được 2,24 lít khí . Tính khối lượng mỗi chất trong hỗn hợp ban đầu
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{Cu}=12-5,6=6,4\left(g\right)\)
Đúng 2
Bình luận (0)
Nhận thấy rừng `Cu` không tác dụng với `HCl` nên toàn bộ lượng `H_2` là do `Fe`
\(n_{H_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:Fe+2HCl->FeCl_2+H_2\)
tỉ lệ 1 : 2 : 1 : 1
n(mol) 0,1<------------------------------0,1
\(m_{Fe}=n\cdot M=0,1\cdot56=5,6\left(g\right)\\ m_{Cu}=12-5,6=6,4\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 12g hỗn hợp gồm Fe và Cu tác dụng với H2SO4 dư---> 2.24l khí a, Nếu đem 12g hỗn hợp X- trên hòa tan trong H2SO4đ,ng thu đc bao nhiêu lít So2(đkc) b, Nếu đem 12g hỗn hợp X trên hòa tan hòa toàn trong dung dịch H2SO4đ,nóng dư thì thu đc bao nhiêu muối sunfat
Fe + H2SO4--> FeSO4 + H2
2Fe+ 6H2SO4 đ,n--> Fe2(SO4)3 + 3SO2 + 6H2O(1)
Cu + 2H2SO4 đ, n --> CuSO4 + 2H2O + SO2(2)
Ta có nH2=2,24/22,4=0,1 mol
=> nFe=0,1 mol
=> mCu=12-5,6=6,4 g
=> nCu=6,4/64= 0, 1mol
Theo PTHH ta có nSO2 (1)=3.nFe/2=0,15 mol
nSO2(2)=nCu=0,1 mol
=> VSO2=(0,15+0,1).22,4=5,6 lít
Ta có nFe2(SO4)3=nFe/2=0,05 mol
nCuSO4=nCu=0,1 mol
=>m muối=0,05.400+ 160.0,1=36 g
Đúng 0
Bình luận (0)
Cho 12g hỗn hợp X (Fe,Cu) vào 200g đe H2SO4 loãng , vừa đủ , sau pư thu được 0.4g khí video , chất rắn A và đe B
a)Tính m mỗi kim loại trong 12g hỗn hợp X
b) tính khối lượng dd B
nH2=0,4/2=0,2
a. Fe+H2SO4\(\rightarrow\)FeSO4+H2
nFe=nH2=0,2
\(\rightarrow\)%mFe=\(\frac{0,2.56}{12}\)=93,33%
\(\rightarrow\)%mCu=6,67%
b. \(\text{mCu=12-0,2.56=0,8}\)
Khối lượng ddB: \(\text{m=12+200-mH2-mCu=210,8}\)
a) Fe+H2SO4--->FeSO4+H2
Chất rắn A là Cu, B là FeSO4
n H2=04/2=0,2(mol)
Theo pthh
n Fe=n H2=0,2(mol)
m Fe=56/0,2=11,2(g)
m Cu=12-11,2=0,8(g)
b) m dd B =m Fe+m dd H2SO4-m H2
=11,2+200-0,4=210,8(g)
Oxi hoá chậm m gam Fe ngoài không khí thu được 12g hỗn hợp A gồm FeO, Fe2O3, Fe3O4 và Fe dư. Hoà tan hỗn hợp A vừa đủ bởi dung dịch HNO3 thu được 2,24 lít NO duy nhất (đktc). Khối lượng m gam Fe ban đầu là:
sử dụng phương pháp bảo toàn electron
‘-Các quá trình cho nhận electron:
Fe0 → Fe3+ + 3e
O20 +4e → 2O2-2
\(\dfrac{m}{56}->\dfrac{3m}{56}\dfrac{12-m}{32}->\dfrac{12-m}{8}\)
=> \(\dfrac{3m}{56}=\dfrac{12-m}{8}\) +0,3 => m = 10,08 (gam)
Đúng 4
Bình luận (0)
cho 12g hỗn hợp fe và ag tá đụng vs hcl, thu đc 3,36l khí h2 ở đktc. tính %khối luộng từng chất