Tính thể tích khí oxi (đktc) và thể tích không khí cần thiết để đốt cháy:
a) 33,6 gam sắt ; b) 2,48 gam photpho
Biết oxi chiếm 20% thể tích không khí.

Những câu hỏi liên quan
Bài 1.
a) Tính thể tích khí oxi và không khí cần thiết để đốt cháy hết 62 gam photpho, biết rằng không khí có 21% về thể tích khí oxi, thể tích các khí đo ở đktc.
b) Nếu đốt cháy 15,5 gam phot pho trong 11,2 lit khí oxi (đktc):
* Chất nào còn dư? Khối lượng là bao nhiêu
* Tính khối lượng chất sản phẩm.
a)
nP =62 : 31 = 2 (mol)
PTHH:4P + 5O2 --(to)-> 2P2O5
Theo PTHH: \(nO_2=\dfrac{5}{4}nP=\dfrac{5}{4}.2=2,5\left(mol\right)\)
VO2(đktc) = 2,5 ×22,4=56 (lít)
\(\dfrac{100\%}{21\%}.56=227\left(lít\right)\)
b)
\(nP=\dfrac{15,5}{31}=0,5\left(mol\right)\)
\(nO_2=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
0,4 0,5 0,2
tính theo pthh : => P dư , O2 đủ
nP(dư) = 0,5-0,4=0,1(mol)
=> mP (dư) = 0,1 . 31 = 3,1(g)
mP2O5 = 0,5 . 142=71(g)
Đúng 3
Bình luận (1)
Đốt cháy 33,6 gam Sắt trong khí oxi.
a. Viết phương trình hóa học của phản ứng.
b. Tính khối lượng oxit sắt từ thu được.
c. Tính thể tích không khí cần dùng (biết thể tích khí oxi chiếm 21% thể tích không khí)
d. Nếu dẫn 8,96 lít hidro (ở đktc) vào ống đựng oxit sắt từ thu được ở phản ứng trên thì sau phản ứng chất nào còn dư và dư bao nhiêu gam?
a, PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b, Ta có: \(n_{Fe}=\dfrac{33,6}{56}=0,6\left(mol\right)\)
Theo PT: \(n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=0,2.232=46,4\left(g\right)\)
c, Theo PT: \(n_{O_2}=\dfrac{2}{3}n_{Fe}=0,4\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,4.22,4=8,96\left(l\right)\) \(\Rightarrow V_{kk}=\dfrac{V_{O_2}}{21\%}\approx42,67\left(l\right)\)
d, PT: \(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,4}{4}\), ta được Fe3O4 dư.
Theo PT: \(n_{Fe_3O_4\left(pư\right)}=\dfrac{1}{4}n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow n_{Fe_3O_4\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)
Đúng 1
Bình luận (0)
a. \(3Fe+2O_2\rightarrow Fe_3O_4\)
b. Số mol Fe: \(n=\dfrac{m}{M}=\dfrac{33,6}{56}=0,6\left(mol\right)\)
PTHH: \(3Fe+2O_2\rightarrow Fe_3O_4\)
Theo PTHH: \(3\) \(2\) \(1\) (mol)
Theo đề: \(0,6\) \(\rightarrow0,2\) (mol)
Kl của \(Fe_3O_4\) là: \(m=n\cdot M=0,2\cdot\left(56\cdot3+16\cdot4\right)=736\left(g\right)\)
Đúng 0
Bình luận (0)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{33,6}{56}=0,6\left(mol\right)\\ PTHH:3Fe+2O_2-^{t^o}>Fe_3O_4\)
tỉ lệ: 3 : 2 : 1
n(mol) 0,6---->0,4-------->0,2
\(m_{Fe_3O_4}=n\cdot M=0,2\cdot\left(56\cdot3+16\cdot4\right)=46,4\left(g\right)\\ V_{O_2\left(dktc\right)}=n\cdot22,4=0,4\cdot22,4=8,96\left(l\right)\\ V_{kk}=8,96:21\%=42,6\left(l\right)\)
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
\(PTHH:4H_2+Fe_3O_4-^{t^o}>3Fe+4H_2O\)
tỉ lệ: 4 : 1 : 3 : 4
n(mol) 0,4 0,2
n(mol pu) 0,4--->0,1----->0,3------->0,4
CL 0---->0,1------>0,3----->0,4
\(\dfrac{n_{H_2}}{4}< \dfrac{n_{Fe}}{1}\left(\dfrac{0,4}{4}< \dfrac{0,2}{1}\right)\)
=> `H_2` hết, `Fe` dư, tính theo `H_2`
\(m_{Fe_3O_4\left(dư\right)}=n\cdot M=0,1\cdot\left(56\cdot3+16\cdot4\right)=23,2\left(g\right)\)
Đúng 0
Bình luận (0)
Tính thể tích khí oxi và thể tích không khí (ở đktc) cần thiết để đốt cháy hoàn toàn:
a) 1,8 gam cacbon. b) 13 gam kẽm. c) 2,7 gam nhôm. Cho biết oxi chiếm 20% thể tích không khí.
nC = 1,8 : 12 = 0,15 (mol)
pthh : C+O2 --> CO2
0,15>0,15 (mol)
=> V O2 = 0,15 .22,4 = 3,36 (l)
=> Vkk = 3,36 : 1/5 = 16,8 (L)
nZn = 13 : 65 = 0,2 (mol)
pthh : 2Zn + O2 -t-> 2ZnO
0,2-----> 0,1 (mol)
=>VO2 = 0,1.22,4 = 2,24 (l)
=> Vkk = 2,24 : 1/5 = 11,2 (l)
nAl = 2,7 : 27 = 0,1 (mol)
pthh : 4Al + 3O2 --t--->2 Al2O3
0,1-->0,075 (mol)
=> VO2 = 0,075 . 22,4 = 1, 68 (l)
=> VKk = 1,68 : 1/5 = 8,4 (l)
Đúng 4
Bình luận (2)
a, nC = 1,8/12 = 0,15 (mol)
PTHH: C + O2 -> (t°) CO2
Mol: 0,15 ---> 0,3
Vkk = 0,3 . 5 . 22,4 = 33,6 (l)
b, nZn = 13/65 = 0,2 (mol)
PTHH: 2Zn + O2 -> (t°) 2ZnO
Mol: 0,2 ---> 0,1
Vkk = 0,1 . 5 . 22,4 = 11,2 (l)
c, nAl = 2,7/27 = 0,1 (mol)
PTHH: 2Al + 3O2 -> (t°) 2Al2O3
Mol: 0,1 ---> 0,075
Vkk = 0,075 . 5 . 22,4 = 8,4 (l)
Đúng 2
Bình luận (1)
a)\(n_C=\dfrac{1,8}{12}=15mol\)
\(C+O_2\underrightarrow{t^o}CO_2\)
15 15 15
\(V_{O_2}=15\cdot22,4=336l\)
\(\Rightarrow V_{kk}=5V_{O_2}=1680l\)
b)\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(2Zn+O_2\underrightarrow{t^o}2ZnO\)
0,2 0,1 0,2
\(V_{O_2}=0,1\cdot22,4=2,24l\)
\(V_{kk}=5V_{O_2}=11,2l\)
c)\(n_{Al}=\dfrac{2,7}{27}=0,1mol\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,1 0,075 0,05
\(V_{O_2}=0,075\cdot22,4=1,68l\)
\(\Rightarrow V_{kk}=1,68\cdot5=8,4l\)
Đúng 2
Bình luận (0)
Tính thể tích khí oxi và thể tích không khí (đktc) cần thiết để đốt cháy: 1,5mol photpho
Cho biết oxi chiếm 20% thể tích không khí.
Phương trình hóa học khi đốt cháy photpho:
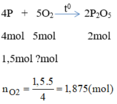
Thể tích của oxi cần: V O 2 = n O 2 .22,4 = 1,875.22,4 = 42(l)
Thể tích của không khí cần dùng là: V k k = 5 V O 2 = 5.42=210(l)
Đúng 0
Bình luận (0)
Tính thể tích khí oxi và thể tích không khí (đktc) cần thiết để đốt cháy: 1mol cacbon
Cho biết oxi chiếm 20% thể tích không khí.
Phương trình phản ứng khi đốt cháy cacbon:
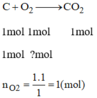
V O 2 = n O 2 .22,4 = 1.22,4 = 22,4(l)
→ V k k = 5 V O 2 = 5.22,4 = 112(l)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam nhôm trong không khí thu được 20,4g nhôm oxit
a. Tính m?
b. Tính thể tích khí O2 ở đktc cần thiết để đốt cháy hết lượng nhôm trên( 2 cách)
c. Tính thể tích kk ở đktc cần thiết để đốt cháy hết lượng nhôm trên, biết thể tích oxi chiếm khoảng 20% thể tích kk?
a) \(n_{Al_2O_3}=\dfrac{20,4}{102}=0,2\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,4<--0,3<---------0,2
=> mAl = 0,4.27 = 10,8(g)
b) C1: VO2 = 0,3.22,4 = 6,72(l)
C2: Theo ĐLBTKL: mO2 = 20,4 - 10,8 = 9,6(g)
=> \(n_{O_2}=\dfrac{9,6}{32}=0,3\left(mol\right)=>V_{O_2}=0,3.22,4=6,72\left(l\right)\)
c) Vkk = 6,72 : 20% = 33,6(l)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 42 gam Sắt trong không khí
a) Viết PTHH xảy ra
b) Tính thể tích oxi và thể tích không khí cần dùng (ở đktc) để đốt cháy hoàn toàn lượng sắt trên
\(n_{Fe}=\dfrac{42}{56}=0,75\left(mol\right)\\ a,PTHH:3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ b,n_{O_2}=\dfrac{2}{3}.0,75=0,5\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,5.22,4=11,2\left(l\right)\\ V_{kk}=5.V_{O_2\left(đktc\right)}=5.11,2=56\left(l\right)\)
Đúng 6
Bình luận (0)
3Fe+2O2-to->Fe3O4
0,75---0,5-- mol
n Fe=\(\dfrac{42}{56}\)=0,75 mol
=>VO2=0,5.22,4=11,2l
=>Vkk=11,2.5=56l
Đúng 0
Bình luận (0)
Tính thể tích khí oxi và thể tích không khí ( đktc) cần thiết để đốt cháy
a) 3.2g lưu huỳnh
b) 6g cacbon
Xem chi tiết
a) PTHH: \(S+O_2\underrightarrow{t^o}SO_2\)
Ta có: \(n_{O_2}=n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\) \(\Rightarrow V_{O_2}=0,1\cdot22,4=2,24\left(l\right)\)
b) PTHH: \(C+O_2\underrightarrow{t^o}CO_2\)
Ta có: \(n_{O_2}=n_C=\dfrac{6}{12}=0,5\left(mol\right)\) \(\Rightarrow V_{O_2}=0,5\cdot22,4=11,2\left(l\right)\)
Đúng 1
Bình luận (0)
a/
Áp dụng công thức \(m=n.M=>n=\dfrac{m}{M}\)
\(=>n_S=\dfrac{m_S}{M_S}=\dfrac{3.2}{32}=0.1\left(mol\right)\)
PTHH
\(S+O_2\underrightarrow{t^o}SO_2\)
1 1
0.1 x
=>\(x=0.1\cdot1:1=0.1=n_{O_2}\)
\(=>V_{O_2}=0.1\cdot22,4=2.24\left(l\right)\)
Đúng 0
Bình luận (0)
a. PT: S + O2 ---> SO2.
Ta có: nS=3,2/32=0,1(mol)
Theo PT, ta có: nS=nO=0,1(mol)
=> VO=0,1.22,4=2,24(l)
=> Vkk=5.VO=5.2,24=11,2(l)
b. PT: C + O2 ---> CO2.
Ta có: nC=6/12=0,5(mol)
Theo PT, ta có: nC=nO=0,5(mol)
=> VO=0,5.22,4=11,2(l)
=> => Vkk=5.VO=5.11,2=56(l)
Đúng 0
Bình luận (0)
Câu 1:Oxi hóa 33,6 gam sắt trong khí oxi.Tính khối lượng hợp chất Fe3O4 thu được?Câu 2:Đốt cháy 6,72 lít khí CH4(đktc) trong không khí.Thể tích không khí cần dùng là bao nhiêu(biết Vkk5V khí oxi)câu 3:nhiệt phân 31,6 gam KMnO4 để điều chế khí O2.Thể tích khí o2 ở đktc là bao nhiêu?câu 4:đốt cháy hoàn toàn 6,2 g P trong bình chứa 8,96 1 khí O2(đktc).khối lượng sản phẩm thu đc là bao nhiêu gam?câu 5:hòa tan 8,1 gam Al vào dd hcl thu đc V lít khí H2 ở dktc .khối lượng sp thu được là bao nhiêu gam?c...
Đọc tiếp
Câu 1:Oxi hóa 33,6 gam sắt trong khí oxi.Tính khối lượng hợp chất Fe3O4 thu được?
Câu 2:Đốt cháy 6,72 lít khí CH4(đktc) trong không khí.Thể tích không khí cần dùng là bao nhiêu(biết Vkk=5V khí oxi)
câu 3:nhiệt phân 31,6 gam KMnO4 để điều chế khí O2.Thể tích khí o2 ở đktc là bao nhiêu?
câu 4:đốt cháy hoàn toàn 6,2 g P trong bình chứa 8,96 1 khí O2(đktc).khối lượng sản phẩm thu đc là bao nhiêu gam?
câu 5:hòa tan 8,1 gam Al vào dd hcl thu đc V lít khí H2 ở dktc .khối lượng sp thu được là bao nhiêu gam?
câu 6 kim loại nào sau đây khoonh phản ứng đc với axit h2so4 loãng?
A.Ag B.Al C.Zn D.Fe
câu 7 kim loại nào sau đây tác dụng đc với nước ở nhiệt độ thường?
A.mg B.Al C.Ba D.Fe
câu 8:tỉ khối của khí A đối với kk là dA/KK>1 khí A là khí nào?
A.co2 B co C h2 D N2
Câu 8:
\(d_{\dfrac{A}{KK}}>1\\ \Leftrightarrow M_A>M_{KK}\\ \Leftrightarrow M_A>29\\ Vậy:Chọn.A\)
(Vì 44>29>28>2)
Đúng 1
Bình luận (0)
\(Câu.7:C\\ Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\\ Câu.6:A\)
Đúng 1
Bình luận (0)
\(Câu.5:\\ n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ n_{AlCl_3}=n_{Al}=0,3\left(mol\right)\\ m_{sp}=m_{AlCl_3}=0,3.133,5=40,05\left(g\right)\)
(Vì khí bay đi, thoát ra nên không tính trong KL Sp thu được)
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Câu 1: Đốt cháy hoàn toàn m gam P trong khí O2 thu được 14,2 gam điphotphopentaoxit.a. Viết PTHHb. Tính giá trị của m.c. Tính thể tích khí oxi cần dùng (đktc).d. Tính thể tích không khí cần thiết để có lượng oxi trên biết oxi chiếm 20% thể tích không khí.Câu 2: Cho 13g kẽm phản ứng hoàn toàn với dung dịch axit clohiđric (dư). a. Tính thể tích khí hiđro sinh ra (ở đktc).b. Tính khối lượng magie clorua sau phản ứng. b. Nếu dùng toàn bộ lượng khí hiđro sinh ra ở trên đem khử hoàn toàn đồng (II) ox...
Đọc tiếp
Câu 1: Đốt cháy hoàn toàn m gam P trong khí O2 thu được 14,2 gam điphotphopentaoxit.
a. Viết PTHH
b. Tính giá trị của m.
c. Tính thể tích khí oxi cần dùng (đktc).
d. Tính thể tích không khí cần thiết để có lượng oxi trên biết oxi chiếm 20% thể tích không khí.
Câu 2: Cho 13g kẽm phản ứng hoàn toàn với dung dịch axit clohiđric (dư).
a. Tính thể tích khí hiđro sinh ra (ở đktc).
b. Tính khối lượng magie clorua sau phản ứng.
b. Nếu dùng toàn bộ lượng khí hiđro sinh ra ở trên đem khử hoàn toàn đồng (II) oxit ở nhiệt độ cao thì sau phản ứng thu được bao nhiêu gam đồng.
Câu 3:Khử hoàn toàn Sắt (III) oxit cần dùng 6,72 lít khí hidro (đktc).
a. Tính khối lượng sắt thu được.
b. Tính khối lượng sắt (III) oxit đã phản ứng.
Câu 4: Cho 4,6 gam Natri vào trong nước thu được dung dịch X và khí H2
a. Tính thể tích khí Hidro (đktc).
b. Tính khối lượng bazo tạo thành.
c. Dung dịch sau phản ứng làm quỳ tím chuyển sang màu gì?
Câu 5: Cho m gam Bari oxit vào trong nước thu được 25,65 gam bari hidroxit
a. Viết PTHH.
b. Tính giá trị của m.
MN GIÚP MÌNH GIẢI VS Ạ
a) PTHH: 4P+5O2-----to---> 2P2O5
0,2 0,25 0,1
b)\(n_{P_2O_5}=\dfrac{m}{M}=\dfrac{14,2}{142}=0,1\left(mol\right)\)
\(m_P=n.M=0,2.31=6,2\left(gam\right)\)
c) \(V_{O_2}=n.22,4=0,25.22,4=5,6\left(l\right)\)
Đúng 1
Bình luận (1)
Câu 2:
\(PTHH:Zn+2HCl\underrightarrow{t^o}ZnCl_2+H_2\)
0,2 0,4 0,2 0,2
\(n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\)
a)\(V_{H_2}=n.22,4=0,2.22,4=4,48\left(l\right)\)
b)\(m_{ZnCl_2}=n.M=\)0,2.136=27,2(gam)
c) PTHH:H2+CuO----to---> H2O+Cu
0,2 0,2 0,2 0,2
mCu=n.M=0,2.64=12,8(gam)
Đúng 0
Bình luận (0)

































