Tính số mol khí CO2 , thế số mol CO2 vào phản ứng. Tam suất ra số mol HCL, tính m chất tan HCL. Tính nồng độ phần trăm HCL.
Giải giúp em với mọi người <3...
Nhỏ từ từ dung dịch HCl dư vào 200 ml dung dịch A chứa KOH và K2CO3. Số mol khí CO2 thu được phụ thuộc vào số mol HCl được biểu diễn theo đồ thị dưới đây (xem như khí CO2 không tan trong nước).
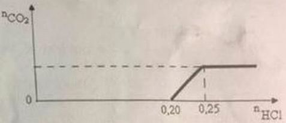
Tính nồng độ mol/lcủa các chất trong dung dịch A.
Pt:
HCl + KOH → KCl + H2O
0,2 → 0,2
Dư: 0,05
2HCl + K2CO3 → 2KCl + CO2↑ + H2O
0,05→ 0,025 0,025
=> CM của KOH và K2CO3 lần lượt là: 1M và 0,125M
Bài 3/ Hoà tan hoàn toàn 14,2g CaCO3 và MgCO3 trong 600 ml dung dịch HCl, sau phản ứng thu được dung dịch chứa 2 muối và giải phóng 3,36 lít CO2 ở đktc.
a/ Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu.
b/ Tính nồng độ mol của dd HCl đã dùng.
a, PT: \(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
\(MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
Ta có: 100nCaCO3 + 84nMgCO3 = 14,2 (1)
Theo PT: \(n_{CO_2}=n_{CaCO_3}+n_{MgCO_3}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CaCO_3}=0,1\left(mol\right)\\n_{MgCO_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CaCO_3}=\dfrac{0,1.100}{14,2}.100\%\approx70,42\%\\\%m_{MgCO_3}\approx29,58\%\end{matrix}\right.\)
b, Theo PT: \(n_{HCl}=2n_{CO_2}=0,3\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,3}{0,6}=0,5\left(M\right)\)
PTHH :
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\)
x 2x x x x
\(MgCO_3+2HCl\rightarrow MgCl_2+H_2O+CO_2\uparrow\)
y 2y y y y
Có:
\(\left\{{}\begin{matrix}100x+84y=14,2\\x+y=\dfrac{3,36}{22,4}=0,15\end{matrix}\right.\)
\(\Rightarrow x=0,1;y=0,05\)
\(a,\%m_{CaCO_3}=0,1.100:14,2.100\%\approx72,423\%\)
\(\%m_{MgCO_3}=100\%-72,423\%\approx29,577\%\)
\(b,C_{M\left(HCl\right)}=\dfrac{0,2+0,1}{0,6}=0,5\left(M\right)\)
Gọi số mol của CaCO3 và MgCO3 lần lượt là x và y => mhỗn hợp = PT(1)
Phương trình hóa học:
CaCO3 CaO + CO2
x mol → x mol
MgCO3 MgO + CO2
y mol → y mol
Hòa tan 130g kẽm trong 1000ml dung dịch hcl Tính thể tích khí hidro thoát ra ở điều kiện tiêu chuẩn Tính nồng độ mol của hcl đã phản ứng Giúp em với ạ em đang cần gấp
\(n_{Zn}=\dfrac{130}{65}=2mol\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=n_{H_2}=2mol\\ V_{H_2}=2.22,4=44,8l\\ 1000ml=1l\\ n_{HCl}=2.2=4mol\\ C_{M_{HCl}}=\dfrac{4}{1}=4M\)
\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{130}{65}=2mol\)
PTHH: Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
TL; 1 2 1 1
mol: 2 \(\rightarrow\) 4
\(m_{HCl}=n.M=4.36,5=146g\)
đổi 1000 ml= 1l
\(C\%_{ddHCl}=\dfrac{m_{HCl}}{V_{HCl}}.100\%=\dfrac{146}{1}.100=14600\%\)
số hơi lớn em xem lại đề nhé
5. Cho 5,6 g sắt vào 100 ml dung dịch HCl . Hãy: Tính thể tích khí H2 tạo ra ở đktc? Tính khối lượng muối thu được. Tính nồng độ MOL dd HCl đã dùng. Tính nồng độ MOL các chất sau phản ứng?
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=0,2\left(mol\right)\\n_{FeCl_2}=0,1\left(mol\right)=n_{H_2}\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\\m_{FeCl_2}=0,1\cdot127=12,7\left(g\right)\\C_{M_{FeCl_2}}=\dfrac{0,1}{0,1}=1\left(M\right)\\C_{M_{HCl}}=\dfrac{0,2}{0,1}=2\left(M\right)\end{matrix}\right.\)
tan hoàn toàn 12,4 g na2o và 200ml dd vừa đủ ( d hcl=1,05g/mol) a,viết pthh , b,tính nồng độ mol của đ hcl đã dùng ,c, tính nồng độ phần trăm của đ sau phản ứng
\(n_{Na_2O}=\dfrac{12,4}{62}=0,2mol\\ a,Na_2O+H_2O\rightarrow2NaOH\\ NaOH+HCl\rightarrow NaCl+H_2O\\ n_{HCl}=n_{NaCl}=0,2.2=0,4mol\\ b,C_{M_{HCl}}=\dfrac{0,4}{0,2}=2M\\ c,m_{ddNaCl}=200.1,05+12,4=222,4g\\ C_{\%NaCl}=\dfrac{0,4.58,5}{222,4}\cdot100=10,52\%\)
Bài 1 :Đốt cháy 16g cacbon trong oxi rhu được 27g CO2 . Tính khối lượng oxi phản ứng.
Bài 2 : Hòa tan hoàn toàn 50g muối ăn vào 200g nước tính nồng đđộphaanf trăm dung dịch thu được
Bài 3 : Trộn 2l dung dịch hcl 4M vào 4l dubg dịch Hcl 0,25 M . Tính nồng độ mol của dung dịch mới
Bài4 Khử 12g Sắt 3 Oxit bằng khí hidro tính thể tích khí hidro ở đktc . Giúp mình vs mai ktra rồi
Cho 9,1g hỗn hợp Cu và Al vào 100ml dd HCl, sau phản ứng thu được 6,72 lít khí thoát ra (đktc). Tính thành phần phần trăm mỗi kim loại có trong hỗn hợp và tính nồng độ mol của dd HCl tham gia phản ứng?
Hòa tan 5,68g hỗn hợp gồm MgCO3 và CaCO3 bằng 1 lít dung dịch HCl 0,5M, khí CO2 sinh ra hấp thụ vào dung dịch nước vôi dư, sau phản ứng dung dịch nước vôi giảm 3,36g.
a. Tính % khối lượng mỗi muối trong A b. Tính nồng độ mol chất trong dung dịch sau phản ứng
a) $CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
n CaCO3 = n CO2 = x(mol)
m giảm = m CaCO3 - m CO2
=> 3,36 = 100x -44x
=> x = 0,06(mol)
Gọi n MgCO3 = a(mol) ; n CaCO3 = b(mol)
=> 84a + 100b = 5,68(1)
$MgCO_3 + 2HCl \to MgCl_2 + CO_2 + H_2O$
$CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O$
n CO2 = a + b = x = 0,06(2)
Từ (1)(2) suy ra a = 0,02 ; b = 0,04
%m MgCO3 = 0,02.84/5,68 .100% = 29,58%
%m CaCO3 = 100% -29,58% = 70,42%
b)
n MgCl2 = a = 0,02(mol)
n CaCl2 = b = 0,04(mol)
n HCl pư = 2a + 2b = 0,12(mol)
=> n HCl dư = 0,5.1 - 0,12 = 0,38(mol)
Vậy :
CM MgCl2 = 0,02/1 = 0,02M
CM CaCl2 = 0,04/1 = 0,04M
CM HCl = 0,38/1 = 0,38M
Cho 15,8 gam KMnO4 vào trong một bình chứa dung dịch HCl (dư). Dẫn toàn bộ khí clo thu
được vào trong một bình kín đã chứa sẵn khí H2 (dư). Bật tia lửa điện trong bình, phản ứng nổ xảy
ra, sau khi phản ứng kết thúc thu được 13,44 lít (đktc) hỗn hợp gồm hai khí. Cho hỗn hợp khí đó
sục vào 97,7 gam nước. Khí HCl tan hết, tạo thành 100 mL dung dịch HCl (d = 1,05 gam/ ml).
(a) Tính nồng độ mol của dung dịch HCl.
(b) Tính hiệu suất của phản ứng điều chế khí clo và số mol hiđro trong bình trước phản ứng.
\(n_{KMnO_4}=\frac{15,8}{158}=0,1\left(mol\right)\)
PTHH : \(2KMnO_4+16HCl-->2KCl+2MnCl_2+5Cl_2+8H_2O\) (1)
\(Cl_2+H_2-as->2HCl\) (2)
Có : \(m_{ddHCl}=100\cdot1,05=105\left(g\right)\)
=> \(m_{HCl}=105-97,7=7,3\left(g\right)\)
=> \(n_{HCl}=\frac{7,3}{36,5}=0,2\left(mol\right)\)
BT Clo : \(n_{Cl_2}=\frac{1}{2}n_{HCl}=0,1\left(mol\right)\)
Mà theo lí thuyết : \(n_{Cl_2}=\frac{5}{2}n_{KMnO_4}=0,25\left(mol\right)\)
=> \(H\%=\frac{0,1}{0,25}\cdot100\%=40\%\)
Vì spu nổ thu được hh hai chất khí => \(\hept{\begin{cases}H_2\\HCl\end{cases}}\) (Vì H2 dư)
=> \(n_{hh}=\frac{13,44}{22,4}=0,6\left(mol\right)\)
=> \(n_{H_2\left(spu\right)}=n_{hh}-n_{HCl\left(spu\right)}=0,6-0,2=0,4\left(mol\right)\)
BT Hidro : \(\Sigma_{n_{H2\left(trong.binh\right)}}=n_{H_2\left(spu\right)}+\frac{1}{2}n_{HCl}=0,4+0,1=0,5\left(mol\right)\)
đọc thiếu đề câu a wtf
\(C_{M\left(HCl\right)}=\frac{0,2}{0,1}=2\left(M\right)\)