cho 3,136 lít khí clo tác dụng với kim loại M ( hóa trị ko đổi ) thu đc 22,94 gam hỗn hợp X . lấy 1/2 hỗn hợp X cho tác dụng với dung dịch Hcl dư thu đc 0.672 lít khí H2 . kim loại M ?
Mọi người giải nhanh giúp em với ạ, em cảm ơn nhiều :))
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
A. Al.
B. Na
C. Ca.
D. K.
Hỗn hợp X gồm Fe và kim loại M có hóa trị không đổi. Cho 15,2 gam X tác dụng với dung dịch HC1 dư, thấy thoát ra 2,24 lít khí H2 (đktc). Nếu cho lượng X như trên tác dụng với dung dịch HNO3 dư, thu được 4,48 lít khí NO (đktc). Kim loại M là
A. Ag.
B. Cu.
C. Al.
D. Mg.
Đáp án B
n H 2 = 0 , 1 ; n NO = 0 , 4 . Gọi n là hóa trị của M.
Căn cứ vào 4 đáp án ta có 2 trường hợp:
+) M là kim loại đứng trước H trong dãy hoạt động hóa học. Khi đó cả M và Fe có phản ứng với dung dịch HCl. Vì hóa trị của M không đổi nên sự chênh lệch về số electron trao đổi trong hai lần thí nghiệm là do sắt có hai mức hóa trị là II và III.
Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có: 2 n Fe + n . n M = 2 n H 2
- Khi hòa tan hỗn hợp vào dung dịch HNO3, ta có: 3 n Fe + n . n M = 3 n NO
Trừ hai vế của hai phương trình cho nhau, ta được:
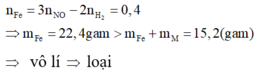
+) M là kim loại đứng sau H và trước Pt trong dãy hoạt động hóa học. Khi đó M không phản ứng được với dung dịch HCl và phản ứng được với dung dịch HNO3. Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có:

Cho 1,37 gam hỗn hợp X gồm Fe và kim loại M hóa trị không đổi tác dụng với dung dịch HCl dư, thấy giải phóng 1,232 lít khí H2 (đktc). Mặt khác hỗn hợp X trên tác dụng vừa đủ với lượng khí Cl2 điều chế được bằng cách cho 3,792 gam KMnO4 tác dụng với dung dịch HCl đặc, dư. Tỉ lệ số mol của Fe và M trong hỗn hợp là 1:3. Kim loại M là
A.Kẽm
B.Nhôm
C. Đồng
D.Magie
Cho 11,2 gam hỗn hợp X gồm Cu và kim loại M tác dụng với dung dịch H2SO4 loãng dư, thu được 3,136 lít khí H2. Cũng lượng hỗn hợp X như vậy cho tác dụng hết với dung dịch H2SO4 đặc nóng dư, thu được 5,88 lít (đktc) khí SO2 (sản phẩm khử duy nhất ). Xác định kim loại M
TH1: Hóa trị `M` đổi `->M:\ Fe`
`Fe^0->Fe^{+2}+2e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `n_{Fe}=n_{H_2}=0,14(mol)`
`->n_{Cu}={11,2-0,14.56}/{64}=0,0525(mol)`
`Cu^0->Cu^{+2}+2e`
`Fe^0->Fe^{+3}+3e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2n_{Cu}+3n_{Fe}=2n_{SO_2}=0,525`
`->2.0,0525+3.0,14=0,525`
Nhận.
`->M` là Iron `(Fe).`
TH2: Hóa trị `M` không đổi.
`M` hóa trị `n`
Đặt `n_{Cu}=x(mol);n_M=y(mol)`
`M^0->M^{+n}+n.e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `ny=2n_{H_2}=0,28`
`->y={0,28}/n(mol)`
`M^0->M^{+n}+n.e`
`Cu^0->Cu^{+2}+2e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2x+ny=2n_{SO_2}=0,525`
`->x={0,525-0,28}/2=0,1225(mol)`
`->m_M=11,2-0,1225.64=3,36(g)`
`->M_M={3,36}/{{0,28}/n}=12n`
`->n=2;M_M=24`
`->M` là magnesium `(Mg).`
Vậy `M` là `Mg` hoặc `Fe.`
Cho 11,2 gam hỗn hợp gồm Cu và kim loại M tác dụng hết với HCl dư thu được 3,136 lít khí (đktc). Cũng lượng hỗn hợp này cho tác dụng hết với dung dịch H2SO4 đặc nóng dư, thu được 5,88 lít khí SO2 (đktc sản phẩm khử duy nhất). Xác định kim loại M và tính % khối lượng Cu trong hỗn hợp
Cho 11,2 gam hỗn hợp gồm Cu và kim loại M tác dụng hết với HCl dư thu được 3,136 lít khí (đktc). Cũng lượng hỗn hợp này cho tác dụng hết với dung dịch H2SO4 đặc nóng dư, thu được 5,88 lít khí SO2 (đktc sản phẩm khử duy nhất). Xác định kim loại M và tính % khối lượng Cu trong hỗn hợp
Cho 11,2 gam hỗn hợp gồm Cu và kim loại M tác dụng hết với HCl dư thu được 3,136 lít khí (đktc). Cũng lượng hỗn hợp này cho tác dụng hết với dung dịch H2SO4 đặc nóng dư, thu được 5,88 lít khí SO2 (đktc sản phẩm khử duy nhất). Xác định kim loại M và tính % khối lượng Cu trong hỗn hợp
Cho 1,37g hỗn hợp X gồm Fe và kim loại M hoá trị không đổi tác dụng với dung dịch HCl dư thấy giải phóng 1,232 lít khí H2 (đkc). Mặt khác hỗn hợp X trên tác dụng vừa đủ với lượng khí Cl2 điều chế được bằng cách cho 3,792 gam KMnO4 tác dụng với dung dịch HCl đặc dư. Tỉ lệ số mol của Fe và M trong hỗn hợp là 1: 3. Kim loại M là
A. Mg
B. Cu
C. Al
D. Zn
Đáp án : C
X + HCl : Fe -> Fe2+ có nH2 = 0,055 mol
X + Cl2 : Fe -> Fe3+
bảo toàn e : 5nKMnO4 = 2nCl2 => nCl2 = 0,06 mol
Do M có hóa trị không đổi => nFe = ne (2) – ne (1) = 2nCl2 – 2nH2 = 0,01 mol
Giả sử M có hóa trị n => n.nM + 2.0,01 = 2nH2 => n.nM = 0,09 mol
Có : mX = 1,37g = 0,01.56 + nM.M => nM.M = 0,81g
=> M = 9n
Nếu n = 3 => M = 27g (Al) Thỏa mãn