Kim loại M hóa trị I tác dụng với nước ở nhiệt độ thường. Hòa tan hoàn toàn 2,16g hỗn hợp X gồm kim loại M và oxit của nó vào 200g nước thu đc dd Y. Để trung hòa Y cần dùng 40ml dd HCl 1M. Hãy xđ kim loại M và C% của dd Y

Những câu hỏi liên quan
Có hh Q gồm kim loại M(có hóa trị II trong hợp chất)oxit và muối clorua của M.Cho20,2g hỗn hợp Q vào dd HCL dư thu đc dd Q1 và 5,6 lít khí H2 (đktc).Lấy toàn bộ dd Q1 cho tác dụng với dd NaOH dư thu đc kết tủa O2.Nung kết tủa O2 đến khối lượng ko đổi thu đc 22g chất rắn.Nếu cũng lấy 20,2g hỗn hợp Q cho vào 300ml dd CuCL2 1M,sau khi phản ứng xong,lọc bỏ chất rắn,làm khô dd thu đc 34,3g muối khan.Giả thiết các phản ứng xảy ra hoàn toàn.Biết rằng kim loại M,oxit của nó ko tan và ko tác dụng với nướ...
Đọc tiếp
Có hh Q gồm kim loại M(có hóa trị II trong hợp chất)oxit và muối clorua của M.Cho20,2g hỗn hợp Q vào dd HCL dư thu đc dd Q1 và 5,6 lít khí H2 (đktc).Lấy toàn bộ dd Q1 cho tác dụng với dd NaOH dư thu đc kết tủa O2.Nung kết tủa O2 đến khối lượng ko đổi thu đc 22g chất rắn.Nếu cũng lấy 20,2g hỗn hợp Q cho vào 300ml dd CuCL2 1M,sau khi phản ứng xong,lọc bỏ chất rắn,làm khô dd thu đc 34,3g muối khan.Giả thiết các phản ứng xảy ra hoàn toàn.Biết rằng kim loại M,oxit của nó ko tan và ko tác dụng với nước ở điều kiện thường ,muối clorua của M tan hoàn toàn trong nước,kim loại M hoạt động hóa học hơn Cu.
a)Viết các pthh và xác định kim loại M
b)Tính thành phần phần trăm về khối lượng các chất trong hỗn hợp Q
Có hh Q gồm kim loại M(có hóa trị II trong hợp chất)oxit và muối clorua của M.Cho20,2g hỗn hợp Q vào dd HCL dư thu đc dd Q1 và 5,6 lít khí H2 (đktc).Lấy toàn bộ dd Q1 cho tác dụng với dd NaOH dư thu đc kết tủa O2.Nung kết tủa O2 đến khối lượng ko đổi thu đc 22g chất rắn.Nếu cũng lấy 20,2g hỗn hợp Q cho vào 300ml dd CuCL2 1M,sau khi phản ứng xong,lọc bỏ chất rắn,làm khô dd thu đc 34,3g muối khan.Giả thiết các phản ứng xảy ra hoàn toàn.Biết rằng kim loại M,oxit của nó ko tan và ko tác dụng với nướ...
Đọc tiếp
Có hh Q gồm kim loại M(có hóa trị II trong hợp chất)oxit và muối clorua của M.Cho20,2g hỗn hợp Q vào dd HCL dư thu đc dd Q1 và 5,6 lít khí H2 (đktc).Lấy toàn bộ dd Q1 cho tác dụng với dd NaOH dư thu đc kết tủa O2.Nung kết tủa O2 đến khối lượng ko đổi thu đc 22g chất rắn.Nếu cũng lấy 20,2g hỗn hợp Q cho vào 300ml dd CuCL2 1M,sau khi phản ứng xong,lọc bỏ chất rắn,làm khô dd thu đc 34,3g muối khan.Giả thiết các phản ứng xảy ra hoàn toàn.Biết rằng kim loại M,oxit của nó ko tan và ko tác dụng với nước ở điều kiện thường ,muối clorua của M tan hoàn toàn trong nước,kim loại M hoạt động hóa học hơn Cu.
a)Viết các pthh và xác định kim loại M
b)Tính thành phần phần trăm về khối lượng các chất trong hỗn hợp Q
Hòa tan hoàn toàn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước , thu được 500ml dd chứa một chất tan có nồng độ 0,04M, và 0,224l khí H2 (đktc). Kim loại M là A. K B. Na C. Ba D. Ca
Đọc tiếp
Hòa tan hoàn toàn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước , thu được 500ml dd chứa một chất tan có nồng độ 0,04M, và 0,224l khí H2 (đktc). Kim loại M là
A. K
B. Na
C. Ba
D. Ca
Đáp án C
M : x mol ; M2On : y mol
M + H2O → M(OH)n + n/2 H2
x x n 2 x
=> n 2 x = 0,01 => nx = 0,02
M2On + nH2O →2M(OH)n
y 2y
⇒ n M(OH)n = x + 2y = 0,02
+) n = 1 (KL kiềm ) ⇒x = 0,02 ; y = 0 ⇒ B. loại
+) n = 2 (KL kiềm thổ) ⇒ x = 0,01 , y = 0,05
⇒ mhh = 0,01.M + 0,05.(2M + 16.2) = 2,9
⇒ M = Ba
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước , thu được 500ml dd chứa một chất tan có nồng độ 0,04M và 0,224l khí H2 (đktc). Kim loại M là: A. K B. Na C. Ba D. Ca
Đọc tiếp
Hòa tan hoàn toàn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước , thu được 500ml dd chứa một chất tan có nồng độ 0,04M và 0,224l khí H2 (đktc). Kim loại M là:
A. K
B. Na
C. Ba
D. Ca
Đáp án B
M : x mol ; M2On : y mol
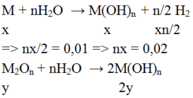
⇒ n M(OH)n = x + 2y = 0,02
+) n = 1 (KL kiềm ) ⇒ x = 0,02 ; y = 0 ⇒ loại
+) n = 2 (KL kiềm thổ) ⇒ x = 0,01 , y = 0,005
⇒ mhh = 0,01.M + 0,005.(2M + 16.2) = 2,9
⇒ M = Ba
Đúng 0
Bình luận (0)
Đem 8,1g hỗn hợp X gồm kim loại M(hóa trị n) và oxit của nó hòa tan hết trong nước dư thu được dung dịch Y. Để trung hòa hết dung dịch Y cần tối thiểu 300ml dung dịch HCl 1M. Tính khối lượng mỗi chất trong hỗn hợp X.
Giúp với ạ cần gấp!
X gồm \(\left\{{}\begin{matrix}M:a\left(mol\right)\\M_2O_n:b\left(mol\right)\end{matrix}\right.\)
=> a.MM + 2b.MM + 16bn = 8,1 (1)
nHCl = 0,3.1 = 0,3 (mol)
PTHH: 2M + 2nH2O --> 2M(OH)n + nH2
a---------------->a
M2On + nH2O --> 2M(OH)n
b---------------->2b
M(OH)n + nHCl --> MCln + nH2O
\(\dfrac{0,3}{n}\)<---0,3
=> \(a+2b=\dfrac{0,3}{n}\) => an + 2bn = 0,3
(1) => \(\dfrac{0,3}{n}.M_M+16bn=8,1\)
Mà bn < 0,15 => MM > 19n (g/mol)
bn < 0 => MM < 27n (g/mol)
=> 19n < MM < 27n
- Với n = 1 => 19 < MM < 27
Mà M và oxit của nó tan trong nước tạo thành dd kiềm
=> M là Na
- Với n = 2 => 38 < MM < 54
Mà M và oxit của nó tan trong nước tạo thành dd kiềm
=> M là Ca
- Với n = 3 => 57 < MM < 81
Mà M và oxit của nó tan trong nước tạo thành dd kiềm
=> Không có TH thỏa mãn
Vậy \(M\left[{}\begin{matrix}Na\\Ca\end{matrix}\right.\)
TH1: M là Na
Có: \(\left\{{}\begin{matrix}23a+62b=8,1\\a+2b=0,3\end{matrix}\right.\)
=> a = 0,15 (mol); b = 0,075 (mol)
=> \(\left\{{}\begin{matrix}m_{Na}=0,15.23=3,45\left(g\right)\\m_{Na_2O}=0,075.62=4,65\left(g\right)\end{matrix}\right.\)
TH2: M là Ca
Có: \(40a+56b=8,1\) (*)
PTHH: Ca + 2H2O --> Ca(OH)2 + H2
a-------------->a
CaO + H2O --> Ca(OH)2
b--------------->b
Ca(OH)2 + 2HCl --> CaCl2 + 2H2O
0,15<-----0,3
=> a + b = 0,15 (**)
(*)(**) => a = 0,01875 (mol); b = 0,13125 (mol)
=> \(\left\{{}\begin{matrix}m_{Ca}=0,01875.40=0,75\left(g\right)\\m_{CaO}=0,13125.56=7,35\left(g\right)\end{matrix}\right.\)
Đúng 3
Bình luận (2)
Hòa tan hoàn toàn 17,88g hỗn hợp gồm 2 kim loại kiềm A, B và kim loại kiềm thổ M vào nước thu được dd Y và 0,24 mol khí H2. Dung dịch Z gồm H2SO4 và HCl, trong đó số mol HCl gấp 4 lần số mol H2SO4. Để trung hòa ½ dd Y cần hết V lit dd Z. Tổng khối lượng muối khan tạo thành trong phản ứng trung hòa là A. 24,7g B. 18,64g C. 27,4g D. 18,46g
Đọc tiếp
Hòa tan hoàn toàn 17,88g hỗn hợp gồm 2 kim loại kiềm A, B và kim loại kiềm thổ M vào nước thu được dd Y và 0,24 mol khí H2. Dung dịch Z gồm H2SO4 và HCl, trong đó số mol HCl gấp 4 lần số mol H2SO4. Để trung hòa ½ dd Y cần hết V lit dd Z. Tổng khối lượng muối khan tạo thành trong phản ứng trung hòa là
A. 24,7g
B. 18,64g
C. 27,4g
D. 18,46g
Gọi nM = x; nA = y; nB = z. M + 2H20 --> M(0H)2 + H2
x...........................x............
A + H20 --> A0H + 1/2H2 y.........................y........y/2
B + H20 --> B0H + 1/2H2 z......................z........z/2
Tổng n OH- là : 2x + y + z
1/2 dung dịch C thì chứa x + y/2 + z/2 mol 0H- chính bằng nH2 = 0,24 mol Ta có : H(+) + 0H(-) --->H20
0,24......0,24
=> tổng nH+ phải dùng là 0,24 mol (1)
mà số phân tử gam HCl nhiều gấp 4 lần số phân tử gam H2SO4. tức nHCl = 4nH2S04 nhưng trong phân tử H2S04 có 2H+
=> nH+ trong HCl = 2 nH+ trong H2S04 (2)
từ 1 và 2 => n H+ trong HCl =n Cl- = nHCl = 0,16 n H+ trong H2S04 = 2nS04(2-) =0,08
m muối = m kim loại + m Cl- + m S04(2-)
= 17,88/2 + 0,08*35,5 + 98*(0,08/2)
= 18,46 g
=> Đáp án D
Đúng 0
Bình luận (0)
Khử hoàn toàn 4,176 g một oxit của kim loại M bằng khí co dư thu đc chất rắn X và hỗn hợp khí Y. Dẫn toàn bộ Y vào dd nước vôi trong dư thấy xuất hiện 7,2 g kết tủa. Hòa tan hoàn toàn lượng X ở trên vào dd h2so4 nồng độ 80%(dd đặc), đun nóng thu đc V lít khí so2(so2 là sản phẩm khí duy nhất) và dd Z. Trong dd Z chỉ chứa 1 chất tan là muối sùnat của kim loại M có nồng đọ 61,069%.làm lạnh dd z thấy tách ra 5,8 g muối rắn. Lọc muối tách ra thấy nồng độ phần trăm của muối trong dd còn lại là 57,215%...
Đọc tiếp
Khử hoàn toàn 4,176 g một oxit của kim loại M bằng khí co dư thu đc chất rắn X và hỗn hợp khí Y. Dẫn toàn bộ Y vào dd nước vôi trong dư thấy xuất hiện 7,2 g kết tủa. Hòa tan hoàn toàn lượng X ở trên vào dd h2so4 nồng độ 80%(dd đặc), đun nóng thu đc V lít khí so2(so2 là sản phẩm khí duy nhất) và dd Z. Trong dd Z chỉ chứa 1 chất tan là muối sùnat của kim loại M có nồng đọ 61,069%.làm lạnh dd z thấy tách ra 5,8 g muối rắn. Lọc muối tách ra thấy nồng độ phần trăm của muối trong dd còn lại là 57,215%. Xác định công thức của muối kim loại và công thức của muối rắn. Tính V. Các phảm ứng xảy ra hoàn toàn, thể tích các khí đo ở đktc.
hòa tan 0.8gam 1 oxit kim loại có hóa trị 2 vào 500ml dd hcl 0.1M .Sau pư thu đc dd Y. Tìm công thức của oxit bik rằng để trung hòa độ HCl dư trong Y ng ta cần dùng 100ml dd NaOH 0.1M
giúp mình nha
=>AO+2HCL->ACL2+H2O(1)
=>HCL+NaOH->NaCL+H2O(2)
(2)=>\(nHCL=nNaOH=\dfrac{100}{1000}.0,1=0,01mol\)
\(\)\(=>nHCL\left(1\right)=\dfrac{500}{1000}.0,1-0,01=0,04mol\)
\(=>nAO=\dfrac{1}{2}nHCL=>=\dfrac{0,8}{A+16}=0,02=>A=24g/mol\)
=>A là Mg =>ct oxit : MgO
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 4 gam hỗn hợp gồm Fe và một kim loại M có hóa trị II trong hợp chất vào dd HCl dư thu được 2,24l khí H2 ( đktc).Nếu chỉ dùng 2,4 gam kim loại M trên cho vào dd HCl thì dùng không hết 0,5 mol HCl. Xác định kim loại M.
\(Fe\left(x\right)+2HCl\left(2x\right)\rightarrow FeCl_2+H_2\left(x\right)\)
\(M\left(y\right)+2HCl\left(2y\right)\rightarrow MCl_2+H_2\left(y\right)\)
Gọi số mol của Fe, M lần lược là x,y thì ta có
\(56x+My=4\left(1\right)\)
\(n_{H_2}=\frac{2,24}{22,4}=0,1\)
\(\Rightarrow x+y=0,1\left(2\right)\)
Nếu chỉ dùng 2,4 g M thì
\(n_{HCl}=2n_M=\frac{2.2,4}{M}=\frac{4,8}{M}< 0,5\left(3\right)\)
Từ (1), (2), (3) ta có hệ: \(\left\{\begin{matrix}56x+My=4\\x+y=0,1\\\frac{4,8}{M}< 0,5\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}56\left(0,1-y\right)+My=4\\x=0,1-y\\\frac{4,8}{M}< 0,5\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}y\left(56-M\right)=1,6\\x=0,1-y\\M>9,6\end{matrix}\right.\)
\(\Rightarrow9,6< M< 56\)
Tới đây thì chọn kim loại nào có hóa trị II mà nằm trong khoản đó và kiểm tra thỏa mãn hệ phương trình là xong.
Đúng 1
Bình luận (8)
Hung Nguyen: giải thích hộ mình ở chỗ dấu ngoặc nhọn thứ 2 đc ko. mình ko hiểu từ dấu ngoặc nhọn thứ nhất làm thế nào để ra đc dấu ngoặc nhọn thứ 2. cảm ơn trước nha ![]()
Đúng 0
Bình luận (2)

















