Cu trong tự nhiên có 2 đồng vị 63Cu và 65Cu. Biết Cu=63,54. Tính % khối lượng 65Cu trong CuSO4

Những câu hỏi liên quan
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54. Tính thành phần % khối lượng của 63Cu trong CuSO4? A. 28,83%. B. 10,97% C. 11,00%. D. 28,74%.
Đọc tiếp
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54. Tính thành phần % khối lượng của 63Cu trong CuSO4?
A. 28,83%.
B. 10,97%
C. 11,00%.
D. 28,74%.
Đáp án A
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
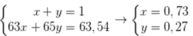
Phần trăm khối lượng của 63Cu trong CuSO4 là
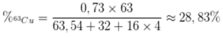
Đúng 0
Bình luận (0)
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. biết nguyên tử khối trung bình của Cu là 63,54. Phần trăm khối lượng của 63Cu trong Cu2O là? A. 73%. B. 64,29%. C. 35,71%. D. 27%.
Đọc tiếp
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. biết nguyên tử khối trung bình của Cu là 63,54. Phần trăm khối lượng của 63Cu trong Cu2O là?
A. 73%.
B. 64,29%.
C. 35,71%.
D. 27%.
Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
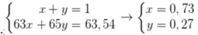
Phần trăm khối lượng của 63Cu trong Cu2O là
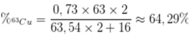
Đúng 1
Bình luận (0)
trong tự nhiên đồng có 2 đồng vị 63cu và 65cu .Nguyên tử khối trung bình của Cu là 63,54. a,Tính phần trăm số nguyên tử mỗi loại đồng vị b.Tính thành phần phần trăm theo khối lượng của 65Cu trong CuSO
a)
Gọi thành phần phần trăm của hai đồng vị 63Cu ,65Cu lần lượt là a,b
Ta có :
a + b = 100%
63a + 65b = 63,54
Suy ra a = 0,73 = 73% ; b = 0,27 = 27%
b) Thành phần phần trăm khối lượng của 65Cu trong CuSO4 là :
\(\dfrac{65.27\%}{63,54 + 32 + 16.4 }.100\% = 11\%\)
Đúng 2
Bình luận (0)
Trong tự nhiên Cu có hai loại đồng vị là 63Cu và 65Cu. Khối lượng nguyên tử trung bình của Cu là 63,54. Hỏi đồng vị 63Cu chiếm bao nhiêu % về khối lượng trong tinh thể CuSO4.5H2O? A. 18,59 % B. 27% C. 73% D. 18,43%
Đọc tiếp
Trong tự nhiên Cu có hai loại đồng vị là 63Cu và 65Cu. Khối lượng nguyên tử trung bình của Cu là 63,54. Hỏi đồng vị 63Cu chiếm bao nhiêu % về khối lượng trong tinh thể CuSO4.5H2O?
A. 18,59 %
B. 27%
C. 73%
D. 18,43%
Gọi x là số phần trăm của đồng vị 63Cu
Suy ra phần trăm đồng vị 65Cu là 100 – x
M = [63.x + 65(100 – x)]/100 = 63,546
<=> x = 72,7%
Từ đây dễ dàng tìm được % của 63Cu trong tinh thể CuSO4.5H2O là 18,43%
=> Đáp án D
Đúng 0
Bình luận (0)
Trong tự nhiên copper có 2 đồng vị 63Cu chiếm 73% và 65Cu a)Tính khối lượng 63Cu trong 7.154g Cu2O b)Tính %m Cu trong CuSO4
`a)`
\(\%m_{^{65}Cu}=100-73=27\%\)
`->M_{Cu}={63.73+65.27}/{100}=63,54(g//mol)`
`n_{Cu_2O}={7,154}/{63,54.2+16}=0,05(mol)`
`->n_{Cu}=0,1(mol)`
\(\to m_{^{63}Cu}=0,1.63,54.73\%=4,63842(g)\)
`b)`
`\%m_{Cu}={63,54}/{63,54+32+16.4}.100\%\approx 39,827\%`
Đúng 2
Bình luận (0)
Trong tự nhiên Cu có hai đồng vị: 63Cu và 65Cu. Khối lƣợng nguyên tử trung bình của Cu là 63,54. Thành phần % về khối lƣợng của 63Cu trong CuCl2 là? Biết MCl = 35,5
\(\overline{NTK}_{Cu}=63,54\\ \Leftrightarrow\dfrac{63.x+65.\left(100\%-x\right)}{100\%}=63,54\\ \Leftrightarrow x=73\%\\ \Rightarrow\%m_{\dfrac{^{63}Cu}{CuCl_2}}=73\%.\dfrac{63,54}{63,54+35,5.2}.100\approx34,476\%\)
Đúng 1
Bình luận (0)
Trong tự nhiên Cu có 2 đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54 đvC. Thành phần phần trăm tổng số nguyên tử của 63Cu là A. 73%. B. 27%. C. 54%. D. 50%.
Đọc tiếp
Trong tự nhiên Cu có 2 đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54 đvC. Thành phần phần trăm tổng số nguyên tử của 63Cu là
A. 73%.
B. 27%.
C. 54%.
D. 50%.
Trong tự nhiên Cu có 2 đồng vị 63Cu (75%) và 65Cu (25%). 2 mol Cu có khối lượng:
A. 120g.
B. 128g.
C. 64g.
D. 127g.
Đáp án D.
Nguyên tử khối trung bình của Cu:

2 mol Cu = 63,5.2=127 gam
Đúng 0
Bình luận (0)
Đồng trong tự nhiên có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình là 63,54.
a/ Xác định phần trăm của mỗi loại đồng vị.
b/ Hỏi mỗi khi có 108 nguyên tử 65Cu thì có bao nhiêu nguyên tử 63Cu?
c/ Tính phần trăm khối lượng của đồng vị 65Cu lần lượt trong Cu2O và CuCl2
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Thành phần % khối lượng của 63Cu trong CuCl2 là (cho Cl 35,5) A. 12,64%. B. 26,77%. C. 27,00%. D. 34,18%.
Đọc tiếp
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Thành phần % khối lượng của 63Cu trong CuCl2 là (cho Cl = 35,5)
A. 12,64%.
B. 26,77%.
C. 27,00%.
D. 34,18%.
Đáp án D
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt
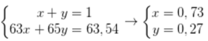
Phần trăm khối lượng của 63Cu trong CuCl2 là
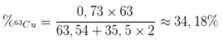
Đúng 0
Bình luận (0)














