Đốt cháy 20g hh Fe và Cu biết nFe:nCu=6:1
Tính khối lượng mỗi chất thu được
Tính khối lượng kim loại có trong hỗn hợp
Tính Vo2 ở đktc cần dùng để đốt cháy hh kim loai trên
Mong các bạn giúp đỡ!!!!!!!!!!!!!!!!
\(a)\\ 4Al+ 3O_2 \xrightarrow{t^o} 2Al_2O_3\\ 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\\ \)
b) Bảo toàn khối lượng :
\(m_{O_2} = 21,8 -13,8 =8(gam)\\ n_{O_2} = \dfrac{8}{32} = 0,25(mol)\\ V_{O_2} = 0,25.22,4 = 5,6(lít)\)
c)
\(n_{Al} = a(mol) ; n_{Fe} = b(mol)\Rightarrow 27a + 56b = 13,8(1)\\ n_{O_2} = 0,75a + \dfrac{2}{3}b = 0,25(2)\\ (1)(2)\Rightarrow a = 0,2 ; b = 0,15\\ \%m_{Al} = \dfrac{0,2.27}{13,8}.100\% =39,13\%\\ \%m_{Fe} = 100\% -39,13\% = 60,87\%\)
Đốt cháy hoàn toàn 7,4 gam hỗn hợp CH4 và C4H10 trong không khí biết rằng sau phản ứng thu được 22 gam khí CO2.
a. Tính khối lượng các chất có trong hỗn hợp đầu ?
b. Tính VO2 cần dùng ( đktc) để đốt cháy hết hỗn hợp trên?
\(a,Đặt:n_{CH_4}=a\left(mol\right);n_{C_4H_{10}}=b\left(mol\right)\left(a,b>0\right)\\ PTHH:CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\\ 2C_4H_{10}+13O_2\rightarrow\left(t^o\right)8CO_2+10H_2O\\ \Rightarrow\left\{{}\begin{matrix}16a+58b=7,4\\22,4a+22,4.4b=22\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{CH_4}=0,1.16=1,6\left(g\right)\\m_{C_4H_{10}}=0,1.58=5,8\left(g\right)\end{matrix}\right.\\ b,n_{O_2}=2a+\dfrac{13}{2}b=2.0,1+6,5.0,1=0,85\left(mol\right)\\ \Rightarrow V_{O_2\left(đktc\right)}=0,85.22,4=19,04\left(l\right)\)
Hỗ hợp A gồm AL và Zn. Tỉ lẹ số mol của AL và Zn là 2/1, đốt cháy hoàn toàn hh A trong khí oxi thu được 18,3 gam chất rắn
a)Tính thành phần phần trăm khối lượng các kim loại trong hỗn hợp ban đầu
b)Tính thể tích oxi cần dùng ở đktc??
(các bn giúp mk nha)(chất rắn lak j lm sao đẻ nhận bt vs trong trường hợp nao vs thường kết hợp vói những hợp chất nào chất tham gia pư vs chất thu dc thường là gì??)
mk đang càn gấp mn giúp mk nha
a) Gọi số mol Al, Zn là 2a, a (mol)
PTHH: 4Al + 3O2 --to--> 2Al2O3
2a-->1,5a---------->a
2Zn + O2 --to--> 2ZnO
a---->0,5a------->a
=> \(102a+81a=18,3\)
=> a = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{0,2.27+0,1.65}.100\%=45,378\%\\\%m_{Zn}=\dfrac{0,1.65}{0,2.27+0,1.65}.100\%=54,622\%\end{matrix}\right.\)
b) \(n_{O_2}=1,5a+0,5a=0,2\left(mol\right)\)
=> \(V_{O_2}=0,2.22,4=4,48\left(l\right)\)
Đốt cháy hết 13,9g hh gồm Cu và Zn trong bình đựng khí O2 thu được 16,1g chất rắn a) Viết pthh b) Tính VO2 ở đktc c) Tính Vkk d) Tính phần trăm về khối lượng các chất trong hh ban đầu
1.Đốt cháy hỗn hợp bột Fe và Mg trong đó khối lượng Mg là 0,48g cần dùng hết 672ml oxi ở đktc.
a)Tính khối lượng hỗn hợp ban đầu
b)Tính thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp
2.Cho dòng khí CO dư đi qua hỗn hợp 2 oxit CuO và Fe2O3 nung nóng thu được 29,6g hỗn hợp 2 kim loại trong đó Fe nhiều hơn Cu 4g.
Tính thể tích khí CO cần dùng ở đktc
Đốt cháy một hỗn hợp gồm bột Fe và Mg, trong đó Mg có khối lượng 0,48g cần dùng 672ml O 2 (ở đktc). Hãy tính khối lượng kim loại Fe.
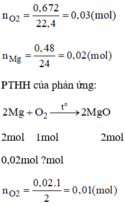
n O 2 còn lại tác dụng Fe là: 0,03 – 0,01 = 0,02 mol
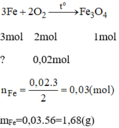
Để đốt cháy hoàn toàn 29,8 gam hỗn hợp gồm Zn và Fe cần 6,72 lít O2 (đktc). Tính % khối
lượng mỗi kim loại trong hỗn hợp và tính khối lượng dung dịch HCl 3,65% cần dùng để
hòa tan hỗn hợp trên.
Gọi nZn = a (mol); nFe = b (mol)
=> 65a + 56b = 29,8 (1)
VO2 = 6,72/22,4 = 0,3 (mol)
PTHH:
2Zn + O2 -> (t°) 2ZnO
a ---> 0,5a ---> a
3Fe + 2O2 -> (t°) Fe3O4
b ---> 2b/3 ---> b/3
=> 0,5a + 2b/3 = 0,3 (2)
Từ (1)(2) => a = 0,2 (mol); b = 0,3 (mol)
=> mZn = 0,2 . 65 = 13 (g)
=> mFe = 0,3 . 56 = 16,8 (g)
PTHH:
Zn + 2HCl -> ZnCl2 + H2
0,2 ---> 0,4
Fe + 2HCl -> FeCl2 + H2
0,3 ---> 0,6
=> mHCl = (0,6 + 0,4) . 36,5 = 36,5 (g)
=> mddHCl = 36,5/3,65% = 1000 (g)
Số mol khí oxi cần dùng là 6,72/22,4=0,3 (mol).
BTKL: 65nZn+56nFe=29,8 (1).
BTe: 2nZn+(8/3)nFe=2nO \(\Leftrightarrow\) 6nZn+8nFe=3,6 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra nZn=0,2 (mol) và nFe=0,3 (mol).
Phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu:
%mZn=0,2.65/29,8\(\approx\)43,62% \(\Rightarrow\) %mFe\(\approx\)100%-43,62%\(\approx\)56,38%.
Số mol HCl cần dùng để hòa tan hồn hợp ban đầu là:
nHCl=2nZn+2nFe=2.0,2+2.0,3=1 (mol).
Khối lượng dung dịch HCl cần dùng là:
m=1.36,5/3,65%=1000 (g).
* Ví dụ 1: Đốt cháy hoàn toàn 7,8 g hỗn hợp 2 kim loại Al và Mg cần dùng 4,48 lít O2 (đktc),sau phản ứng kết thúc thu được hỗn hợp chất rắn gồm Al2O3 và MgO.
a. Tính khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
b. Tính khối lượng của Al2O3 và MgO thu được sau phản ứng.
Ví dụ 2: Để đốt cháy hết 6,72 lít hỗn hợp khí CH4 và C2H6 cần dùng 24 gam O2 , sau phản ứng thu được CO2 và H2O.
a. Tính khối lượng của mỗi khí trong hỗn hợp ban đầu.
b. Tính thể tích khí CO2 thu được sau phản ứng. Biết các thể tích khí đều đo ở đktc.
giúp tui!
Đốt cháy 40,4 gam hỗn hợp gồm Cu, Fe ,Al thu được 59,6 gam oxit. Lấy toàn bộ oxit thu được phản ứng với V lít H2 (đktc) thu được chất rắn A có khối lượng là 50 gam
a,Tính khối lượng mỗi kim loại trong hỗn hợp.
b,Tính V.
a, PT: \(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
Gọi: \(\left\{{}\begin{matrix}n_{Cu}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\\n_{Al}=z\left(mol\right)\end{matrix}\right.\) ⇒ 64x + 56y + 27z = 40,4 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{CuO}=n_{Cu}=x\left(mol\right)\\n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=\dfrac{1}{3}y\left(mol\right)\\n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=\dfrac{1}{2}z\left(mol\right)\end{matrix}\right.\)
⇒ 80x + 232.1/3x + 102.1/2z = 59,6 (2)
- Chất rắn A gồm: Cu, Fe và Al3O3.
⇒ 64x + 56y + 102.1/2z = 50 (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,3\left(mol\right)\\z=0,4\left(mol\right)\end{matrix}\right.\)
⇒ mCu = 0,2.64 = 12,8 (g)
mFe = 0,3.56 = 16,8 (g)
mAl = 0,4.27 = 10,8 (g)
b, Theo PT: \(n_{H_2}=n_{Cu}+\dfrac{4}{3}n_{Fe}=0,6\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,6.22,4=13,44\left(l\right)\)