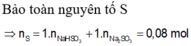hấp thụ hoàn toàn 336 ml CO2 ở điều kiện tiêu chuẩn vào 50ml dung dịch NaOH thu được 1,48 gam muối .tính nồng độ mol của NAOH

Những câu hỏi liên quan
Cho 10 gam CaCO3 tác dụng vừa đủ với 100ml dung dịch HCl
a) Viết phương trình
b) tính thể tích CO2 sinh ra ở (điều kiện tiêu chuẩn)
c) tính nồng độ mol của dung dịch HCl
d) Dẫn toàn bộ khí CO2 thu được hấp thụ hết 550 gam dung dịch NaOH 10%. tính khối lượng muối tạo thành (Ca=40,C=12,O=16,Na=23)
a, \(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
b, \(n_{CaCO_3}=\dfrac{10}{100}=0,1\left(mol\right)\Rightarrow n_{CO_2}=n_{CaCO_3}=0,1\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,1.22,4=2,24\left(l\right)\)
c, \(n_{HCl}=2n_{CaCO_3}=0,2\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,2}{0,1}=2\left(M\right)\)
d, \(m_{NaOH}=550.10\%=55\left(g\right)\Rightarrow n_{NaOH}=\dfrac{55}{40}=1,375\left(mol\right)\)
\(\Rightarrow\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{1,375}{0,1}=13,75>2\)
→ Pư tạo muối trung hòa Na2CO3.
PT: \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
\(n_{Na_2CO_3}=n_{CO_2}=0,1\left(mol\right)\Rightarrow m_{Na_2CO_3}=0,1.106=10,6\left(g\right)\)
Đúng 2
Bình luận (0)
hấp thụ hoàn toàn 0,048 lít khí Clo ở điều kiện tiêu chuẩn vào bởi 50 ml dung dịch NaOH 1 M Tính nồng độ Cm của các chất trong dung dịch thu được
giúp mình với ạ
\(n_{Cl_2}=\dfrac{0.0448}{22.4}=0.002\left(mol\right)\)
\(n_{NaOH}=0.05\cdot1=0.05\left(mol\right)\)
\(2NaOH+Cl_2\rightarrow NaCl+NaClO+H_2O\)
\(2.................1\)
\(0.05........0.002\)
LTL : \(\dfrac{0.05}{2}>\dfrac{0.002}{1}\)
NaOH dư
\(C_{M_{NaCl}}=C_{M_{NaClO}}=\dfrac{0.002}{0.05}=0.04\left(M\right)\)
\(C_{M_{NaOH\left(dư\right)}}=\dfrac{0.05-0.002\cdot2}{0.05}=0.92\left(M\right)\)
Đúng 5
Bình luận (2)
hấp thụ hoàn toàn 3,36 lít khí CO2 (điều kiện tiêu chuẩn) vào dung dịch chứa 0,15 mol NaOH và 0,1 mol Ba(OH)2 thu được m gam kết tủa. Giá trị của m là A. 14,775 B. 9,850 C. 29,550 D. 19,700
Đọc tiếp
hấp thụ hoàn toàn 3,36 lít khí CO2 (điều kiện tiêu chuẩn) vào dung dịch chứa 0,15 mol NaOH và 0,1 mol Ba(OH)2 thu được m gam kết tủa. Giá trị của m là
A. 14,775
B. 9,850
C. 29,550
D. 19,700
Đáp án : D
nCO2 = 0,15mol; nOH- =0,15 + 2.0,1=0,35mol
=> nOH-/nCO2 >2
=> nCO32- =nCO2 = 0,15mol
Ba2+ + CO32- →BaCO3$
0,1 0,15 0,1 mol
=>m=197.0,1= 19,7 g
Đúng 0
Bình luận (0)
Hấp thụ 4,48 lít khí SO2 ở điều kiện tiêu chuẩn vào trong 200ml dung dịch NaOH 1,25M. Sau phản ứng thu được dung dịch X.
1. Tính khối lượng muối có trong X.
2. Tính nồng độ mol/l các chất trong X.
3. Cho Ba(OH)2 dư vào dung dịch X thu được m gam kết tủa. tính m
Please, giúp mình với!
mình cảm ơn.
Số mol SO2 và NaOH lần lượt là 0,2 và 0,25.
1 < OH-/SO2=1,25 < 2 ⇒ Dung dịch X chứa hai muối Na2SO3 và NaHSO3.
\(n_{Na_2SO_3}=0,25-0,2=0,05\left(mol\right)\) ⇒ \(n_{NaHSO_3}=0,2-0,05=0,15\left(mol\right)\).
1. Khối lượng muối có trong X:
m=0,05.126+0,15.104=21,9 (g).
2. Nồng độ mol/l các chất trong X:
\(C_{M\left(Na_2SO_3\right)}\)=0,05/0,2=0,25 (mol/l).
\(C_{M\left(NaHSO_3\right)}\)=0,15/0,2=0,75 (mol/l).
3. Khối lượng kết tủa BaSO3 là:
m'=0,2.217=43,4 (g).
Đúng 3
Bình luận (2)
Nhiệt phân hoàn toàn 166g MgCO3 và BaCO3,thu được V lít CO2 ở điều kiện tiêu chuẩn cho V lít CO2 hấp thụ vào dung dịch chứa 1,5 mol NaOH thêm BaCl2 dư,thấy tạo 118,2 gam kết tủa xác định thành phần phần trăm theo khối lượng các chất trong thành phần mỗi muối ban đầu?
$Na_2CO_3 + BaCl_2 \to BaCO_3 + 2NaCl$
$n_{Na_2CO_3} = n_{BaCO_3} = \dfrac{118,2}{197} = 0,6(mol)$
Gọi $n_{MgCO_3} = a; n_{BaCO_3} = b$
$\Rightarrow 84a + 197b = 166(1)$
$2NaOH + CO_2 \to Na_2CO_3 + H_2O$
$NaOH + CO_2 \to NaHCO_3$
TH1 : $NaOH$ dư
$\Rightarrow n_{CO_2} = a + b = n_{Na_2CO_3} = 0,6(2)$
Từ (1)(2) suy ra a = -0,42 < 0 $\to$ Loại
TH2 : Có tạo muối axit
$\Rightarrow n_{NaHCO_3} = 1,5 - 0,6.2 = 0,3$
$\Rightarrow n_{CO_2} = a + b = 0,6 + 0,3 = 0,9(3)$
Từ (1)(3) suy ra a = 0,1 ; b = 0,8
$\%m_{MgCO_3} = \dfrac{0,1.84}{166}.100\% = 5,06\%$
$\%m_{BaCO_3} = 100\% -5,06\% = 94,94\%$
Đúng 5
Bình luận (2)
Tham khảo:
Ta có: nBaCO3=0,6 mol
BaCl2+Na2CO3→BaCO3+2NaCl
⇒nNa2CO3=0,6 mol
TH1: tạo 2 muối Na2CO3,NaHCO3
Tacó: nNaOH=1,5→nNaHCO3=1,5−0,6.2=0,3 mol
Khi đó BTNT C: nCO2=nNa2CO3+nNaHCO3=0,9 mol
Đặt a, b lần lượt là mol của MgCO3,BaCO3
Đúng 1
Bình luận (7)
Đốt cháy hoàn toàn m gam S có trong oxi dư, hấp thụ toàn bộ sản phẩm cháy vào 120 ml dung dịch NaOH 1M, thu được dung dịch chứa 2 muối có cùng nồng độ mol. Giá trị của m là:
A. 3,84.
B. 2,56.
C. 3,20.
D. 1,92.
Đốt cháy hoàn toàn m gam S có trong oxi dư, hấp thụ toàn bộ sản phẩm cháy vào 120 ml dung dịch NaOH 1M, thu được dung dịch chứa 2 muối có cùng nồng độ mol. Giá trị của m là A. 3,84. B. 2,56. C. 3,20. D. 1,92.
Đọc tiếp
Đốt cháy hoàn toàn m gam S có trong oxi dư, hấp thụ toàn bộ sản phẩm cháy vào 120 ml dung dịch NaOH 1M, thu được dung dịch chứa 2 muối có cùng nồng độ mol. Giá trị của m là
A. 3,84.
B. 2,56.
C. 3,20.
D. 1,92.
Đốt cháy hoàn toàn m gam S có trong oxi dư, hấp thụ toàn bộ sản phẩm cháy vào 120 ml dung dịch NaOH 1M thì thu được dung dịch chứa 2 muối có cùng nồng độ mol. Giá trị của m là A. 3,84 gam B. 2,56 gam C. 3,20 gam D. 1,92 gam
Đọc tiếp
Đốt cháy hoàn toàn m gam S có trong oxi dư, hấp thụ toàn bộ sản phẩm cháy vào 120 ml dung dịch NaOH 1M thì thu được dung dịch chứa 2 muối có cùng nồng độ mol. Giá trị của m là
A. 3,84 gam
B. 2,56 gam
C. 3,20 gam
D. 1,92 gam
1. Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100ml dd NaOH. Sau phản ứng nung từ từ dung dịch thu đc 9,5g muối khan. Tính nồng độ mol của dd NaOH đã dùng
2. Người ta dẫn 2,24 lít CO2 qua bình đựng dd NaOH. Khí CO2 bị hấp thụ hoàn toàn. Sau phản ứng thu được muối nào tạo thành? khối lượng là bn?
1.nCO2=0,1 (mol )
TH1: Số mol của CO2 dư => Khối lượng muối khan tối đa tạo được là:
mmuối=0,1.84=8,4<9,5 (loại )
TH2: CO2 hết
Gọi số mol CO2 tạo muối Na2CO3;NaHCO3 lần lượt là x, y
2NaOH+CO2→Na2CO3+H2O
NaOH+CO2→NaHCO3
Ta có : \(\left\{{}\begin{matrix}x+y=0,1\\106x+84y=9,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,05\end{matrix}\right.\)
⇒nNaOH=2.0,05+0,05=0,15 (mol)
⇒CMNaOH=\(\dfrac{0,15}{0,1}\)=1,5M
Đúng 3
Bình luận (4)
Câu 2 thật ra anh thấy chưa chặt chẽ nha!
Đúng 0
Bình luận (3)
2. Vì CO2 bị hấp thụ hoàn toàn
=> CO2 hết, NaOH dư
nCO2 = 0,1 (mol)
CO2 + 2NaOH -------> Na2CO3 + H2O
\(n_{Na_2CO_3}=n_{CO_2}=0,1\left(mol\right)\)
=> \(m_{Na_2CO_3}=0,1.106=10,6\left(g\right)\)
Đúng 1
Bình luận (0)