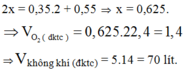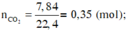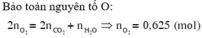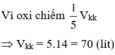Đốt cháy hoàn toàn 56 lít khí thiên nhiên ( đktc) gồm 89,6% CH4 ; 2,24% C2H6 ; 4% CO2 và 4,16% N2.Dẫn toàn bộ sản phẩm qua dung dịc nước vôi trong dư thì thu được bao nhiêu g kết tủa

Những câu hỏi liên quan
Đốt cháy hoàn toàn 32 gam khí metan (CH4) cần V lít khí oxi (đktc), thu được khí CO2 và H2O. Giá trị của V là
A. 22,4 lít.
B. 89,6 lít.
C. 44,8 lít.
D. 67,2 lít.
Số mol khí CH4 là: nCH4= ![]() =2 mol
=2 mol
PTHH: CH4 + 2O2![]() CO2 + 2H2O
CO2 + 2H2O
Tỉ lệ PT: 1mol 2mol
Phản ứng: 2mol → 4mol
=> thể tích khí oxi cần dùng là: VO2=22,4.n=22,4.4=89,6 lít
Đáp án cần chọn là: B
Đúng 2
Bình luận (0)
\(n_{CH_4}=\dfrac{32}{16}=2\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
2---->4
=> V = 4.22,4 = 89,6 (l)
=> B
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là: A. 70,0 lít B. 78,4 lít C. 84,0 lít D. 56,0 lít
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là:
A. 70,0 lít
B. 78,4 lít
C. 84,0 lít
D. 56,0 lít
Đáp án A
Hỗn hợp khí gồm CH4, C2H6 và C3H8 là các hidrocacbon.
Mà khi đốt cháy 1 hidrocacbon bất kì ta luôn có:
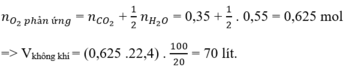
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là : A. 78,4 lít B. 56,0 lít C. 70,0 lít D. 84,0 lít
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là :
A. 78,4 lít
B. 56,0 lít
C. 70,0 lít
D. 84,0 lít
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là A. 70,0 lít B. 84,0 lít C. 56,0 lít. D. 78,4 lít.
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là
A. 70,0 lít
B. 84,0 lít
C. 56,0 lít.
D. 78,4 lít.
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là: A. 70,0 lít. B. 78,4 lít. C. 84,0 lít. D. 56,0 lít.
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là:
A. 70,0 lít.
B. 78,4 lít.
C. 84,0 lít.
D. 56,0 lít.
Câu 4: Đốt cháy một hỗn hợp gồm CH4 và C2H2 có thể tích là 33,6 lít (đktc) thu được 56 lít khí CO2 (đktc).a. Xác định thành phần % về thể tích các khí trong hỗn hợp?b. Tính khối lượng của oxi cần để đốt cháy hoàn toàn hỗn hợp khí trên?
Đọc tiếp
Câu 4: Đốt cháy một hỗn hợp gồm CH4 và C2H2 có thể tích là 33,6 lít (đktc) thu được 56 lít khí CO2 (đktc).
a. Xác định thành phần % về thể tích các khí trong hỗn hợp?
b. Tính khối lượng của oxi cần để đốt cháy hoàn toàn hỗn hợp khí trên?
a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Ta có: \(n_{CH_4}+n_{C_2H_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\left(1\right)\)
Theo PT: \(n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=\dfrac{56}{22,4}=2,5\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,5\left(mol\right)\\n_{C_2H_2}=1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,5.22,4}{33,6}.100\%\approx33,33\%\\\%V_{C_2H_2}\approx66,67\%\end{matrix}\right.\)
b, Theo PT: \(n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=3,5\left(mol\right)\Rightarrow m_{O_2}=3,5.32=112\left(g\right)\)
Đúng 3
Bình luận (1)
Đốt cháy hoàn toàn một thể tích khí thiên nhiêm gồm: metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là A. 84,0 lít B. 70,0 lít C. 78,4 lít D. 56,0 lít
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiêm gồm: metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là
A. 84,0 lít
B. 70,0 lít
C. 78,4 lít
D. 56,0 lít
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí
CO
2
(đktc) và 9,9 gam nước. Thể tích không khí (dktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là A. 70,0 lít B. 78,4 lít C. 84,0 lít D. 56,0 lít
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO 2 (đktc) và 9,9 gam nước. Thể tích không khí (dktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là
A. 70,0 lít
B. 78,4 lít
C. 84,0 lít
D. 56,0 lít
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. thể tích không khí (dktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên niên trên là : A. 70,0 lít B. 78,4 lít C. 84,0 lít D. 56,0 lít
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. thể tích không khí (dktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên niên trên là :
A. 70,0 lít
B. 78,4 lít
C. 84,0 lít
D. 56,0 lít
Đáp án A
n C O 2 = 7 , 84 22 , 4 = 0 , 35 ( m o l ) ; n H 2 O = 9 , 9 18 = 0 , 55 ( m o l )
Bảo toàn nguyên tố O:
2 n O 2 = 2 n C O 2 + n H 2 O ⇒ n O 2 = 0 , 625 ( m o l ) ⇒ V O 2 = 0 , 625 . 22 , 4 = 14 l
Vì oxi chiếm 1/5 Vkk => Vkk = 5.14 = 70 (lít)
Đúng 0
Bình luận (0)
Bài 1: Đốt cháy hoàn toàn một hidrocacbon X thu được 0,1 mol CO2 và 0,15 mol H2O. Tìm tên gọi của X
Bài 2: Khi đốt cháy hoàn toàn 4,48 lít hỗn hợp khí gồm CH4, C2H6, C3H8 (đktc) thu được V lít khí CO2(đktc) và 18g H2O. Tìm V
Bài 1 :
\(n_{H_2O}>n_{CO_2}\Rightarrow X:ankan\)
\(Đặt:CTHH:C_nH_{2n+2}\)
\(\dfrac{n}{2n+2}=\dfrac{0.1}{0.3}\Rightarrow n=2\)
\(Vậy:Xlà:C_2H_6\left(etan\right)\)
Đúng 1
Bình luận (0)
Bài 1
\(n_{CO_2} < n_{H_2O} \to\) X là ankan (CnH2n+2)
\(n_X = n_{H_2O} - n_{CO_2} = 0,15 - 0,1 = 0,05(mol)\)
Suy ra: \(n = \dfrac{n_{CO_2}}{n_X} = \dfrac{0,1}{0,05} = 2\)
Vậy X là C2H6(etan)
Bài 2 :
Hỗn hợp có dạng CnH2n+2
\(n_{hỗn\ hợp} = \dfrac{4,48}{22,4} = 0,2(mol)\\ n_{H_2O} = \dfrac{18}{18} = 1(mol)\\ \Rightarrow n + 2 = \dfrac{2n_{H_2O}}{n_{hh}} = 5\\ Suy\ ra\ n = 3\)
\(\Rightarrow n_{CO_2} = 3n_{hh} = 0,2.3 = 0,6(mol)\\ \Rightarrow V = 0,6.22,4 = 13,44(lít)\)
Đúng 1
Bình luận (0)
Bài 2 :
\(n_{H_2O}=\dfrac{18}{18}=1\left(mol\right)\)
\(n_{ankan}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(n_{CO_2}=n_{H_2O}-n_{ankan}=1-0.2=0.8\left(mol\right)\)
\(V_{CO_2}=0.8\cdot22.4=17.92\left(l\right)\)
Đúng 0
Bình luận (0)