cho một lượng nhôm oxit tác dụng vừa đủ với 300ml dd axit sunfuric 4,9% (d=1.08)
a, tính khối lượng nhôm oxit cần dùng để tác dụng hết với lượng axit đã cho
b, tính số g muối thu được sau phản ứng
cho một lượng nhôm oxit tác dụng vừa đủ với 300 ml dd axit sunfuric 4,9 % (d = 1,08)
a tính khối lượng nhôm oxit cần dùng để tác dụng hết với lượng axit đã cho
b tính số g muối thu được sau phản ứng
1) Cho 15,3 gam nhôm oxit tác dụng vừa đủ với m gam dung dịch axit clohiđric 20% a. Tìm giá trị m =? b. Tính khối lượng dung dịch thu được sau phản ứng? c. Tính C% của muối thu được? 2) Cho m gam nhôm oxit tác dụng vừa đủ với 54,75 gam dung dịch axit clohiđric 20% a. Tìm giá trị m=? b. Tính C% của muối thu được?
1)
a, \(n_{Al}=\dfrac{15,3}{102}=0,15\left(mol\right)\)
PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O
Mol: 0,15 0,9 0,3
\(m_{ddHCl}=\dfrac{0,9.36,5.100}{20}=164,25\left(g\right)\)
b, mdd sau pứ = 15,3 + 164,25 = 179,55 (g)
c, \(C\%_{ddAlCl_3}=\dfrac{0,3.133,5.100\%}{179,55}=22,31\%\)
2)
a, \(m_{HCl}=54,75.20\%=10,95\left(g\right)\Rightarrow n_{HCl}=\dfrac{10,95}{36,5}=0,3\left(mol\right)\)
PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O
Mol: 0,05 0,3 0,1
\(m_{Al_2O_3}=0,05.102=5,1\left(g\right)\)
b, mdd sau pứ = 5,1 + 54,75 = 59,85 (g)
\(C\%_{ddAlCl_3}=\dfrac{0,1.133,5.100\%}{59,85}=22,31\%\)
Cho nhôm oxit ( Al2O3) tác dụng với 9,8g axit sunfuric ( H2SO4 ) thu được nhôm sunfat ( Al2(SO4)3 ) và nước . a) Lập phương trình hóa học của phản ứng trên b) tính khối lượng Al đã tham gia c) Tính thể tích H2(đktc) thu được d)Dùng hết lượng khí trên khử đồng (3) oxi ở nhiệt độ cao tính khối lượng Cu thu được
Nhôm (III) oxit tác dụng với axit sunfuric theo phương trình phản ứng sau :
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tính lượng muối nhôm sunfat được tạo thành nếu đã sử dụng 49g axit sunfuric nguyên chất tác dụng với 60g nhôm oxit. Sau phản ứng chất nào còn dư ? Lượng dư của chất đó là bao nhiêu ?
Phương trình hóa học của phản ứng:
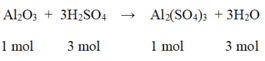
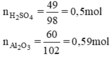
So sánh tỉ lệ 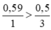 → Vậy Al2O3 dư
→ Vậy Al2O3 dư
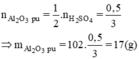
mAl2O3 (dư) = 60 - 17 = 43(g)
Cho nhôm oxit ( Al2O3) tác dụng với 9,8g axit sunfuric ( H2SO4 ) thu được nhôm sunfat
( Al2(SO4)3 ) và nước .
a) Lập phương trình hóa học của phản ứng trên
b) tính số mol H2SO4 cần dùng và khối lượng của Al2(SO4)3 thu được
c) Tính khối lượng Al2O3 cần dùng cho phản ứng trên
MÌNH ĐANG CẦN GẤP GIÚP MÌNH VỚI
a) Pt : Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
1 3 1 3
0,03 0,1 0,03
b) Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
Số mol của nhôm sunfat
nAl2(SO4)3 = \(\dfrac{0,1.1}{3}=0,03\left(mol\right)\)
Khối lượng của nhôm sunfat
mAl2(SO4)3 = nAl2(SO4)3 . MAl2(SO4)3
= 0,03 . 342
= 10,26 (g)
c) Số mol của nhôm oxit
nAl2O3 = \(\dfrac{0,1.1}{3}=0,03\left(mol\right)\)
Khối lượng của nhôm oxit
mAl2O3 = nAl2O3 . MAl2O3
= 0,03 . 102
= 3,06 (g)
Chúc bạn học tốt
3. Cho 9,4 g hỗn hợp nhôm và đồng tác dụng với axit sunfuric vừa đủ. Sau phản ứng thấy có 4 g chất rắn không tan.
a) Tính thể tích khí thoát ra ở đktc.
b) Lượng khí thu được trên khử vừa đủ một lượng sắt III oxit ở nhiệt độ cao. Tính khối lượng của sắt III oxit đó.
Cho 10,2g nhôm oxit Al2O3 tác dụng hoàn toàn với xg axit clohiđric HCl. Sau phản ứng thu được muối nhôm clorua (AlCl3) và nước A. Lập PTHH. Al2O3+6HCl----> 2 AlCl3 + 3 H2O B. Tính khối lượng axit clohiđric cần dùng
a, PT: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2\)
b, Ta có: \(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
Theo PT: \(n_{HCl}=6n_{Al_2O_3}=0,6\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,6.36,5=21,9\left(g\right)\)
Cho 10,2 gam nhôm oxit tác dụng vừa đủ với m gam dung dịch axit clohiđric 7,3% .
a. Tìm giá trị m = ?
b. Tính khối lượng dung dịch thu được sau phản ứng
c. Tính C% của muối thu được ?
nAl2O3= 10,2/102= 0,1(mol)
a) PTHH: Al2O3 + 6 HCl -> 2 AlCl3 + 3 H2O
0,1_______0,6_______0,2_________0,3(mol)
mHCl=0,6.36,5= 21,9(g)
=>mddHCl= (21,9.100)/7,3=300(g)
b) mddsau= mAl2O3 + mddHCl= 10,2+300=310,2(g)
c) mAlCl3= 133,5.0,2=26,7(g)
=>C%ddAlCl3= (26,7/310,2).100=8,607%
cho kim loại nhôm tác dụng vừa đủ với dung dịch axit sunfuric(H2SO4). sau phản ứng thu được muối sunfat (Al2(SO4)3) vaf3,36 lit khí hidro ở dktc.
a) lập PTHH cho phản ứng
b)tính khối lượng nhôm đẫ tham gia phản ứng
c) tính khối lượng muối nhôm sunfat thu được sau phản ứng.
d) dẫn toàn bộ lượng khí hidro thu được ở trên vào bình đựng khí oxi rồi đốt cháy. hỏi chất nào dư sau phản ứng và thế tích còn dư bao nhiêu/ biết sản phâm thu được là nước (H2O)
e) nếu hiệu suất của phản ứng H=80%. hãy tính khối lượng của axit clohidric thực tế đã lấy và khối lượng Zn ban đầu.
a: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b: \(n_{H2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(\Leftrightarrow n_{Al}=0.1\left(mol\right)\)
\(m_{Al}=n_{Al}\cdot M_{Al}=0.1\cdot27=2.7\left(g\right)\)