Để điều chế khí hiđrô người ta cho 22,4 g sắt tác dụng với dung dịch chứa 24,5 g axit sunfuric loãng.
a. Sau phản ứng có chất nào còn dư không? Tính khối lượng chất dư?
b. Tính thể tích khí hiđrô (đktc) và khối lượng muối thu được sau phản ứng?
c. Phải dùng thêm dung dịch chứa bao nhiêu gam axit sunfuric nữa để phản ứng hết với lượng sắt dư?



























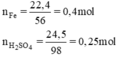

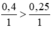 ⇒ Fe dư
⇒ Fe dư