lấy cùng một lượng kclo3 và kmno4 để điều chế khí o2. chất nào cho the tich o2 hơn ?

Những câu hỏi liên quan
Nung a gam KClO3 và b gam KMnO4 thu được cùng một lượng O2. Tính tỉ lệ a/b
Câu 8. Lấy cùng một lượng KClO3 và KMnO4 để điều chế khí O2. Chất nào cho nhiều khí O2 hơn.
Lấy cùng một lượng
K
C
l
O
3
và
K
M
n
O
4
để điều chế oxi. Chất nào tạo ra nhiều khí
O
2
hơn. Nếu điều chế dùng một thể tích khí oxi thì dùng chất nào kinh tế hơn? Biết rằng giá
K
M
n
O
4
là 30.000 đ/kg và
K
C
l...
Đọc tiếp
Lấy cùng một lượng K C l O 3 và K M n O 4 để điều chế oxi. Chất nào tạo ra nhiều khí O 2 hơn. Nếu điều chế dùng một thể tích khí oxi thì dùng chất nào kinh tế hơn? Biết rằng giá K M n O 4 là 30.000 đ/kg và K C l O 3 là 96.000 đ/kg.
Giả sử cần điều chế 3,36lit O 2 tương đương với 0,15 mol O 2
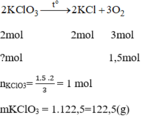
Số tiền mua 122,5g để điều chế 1,5mol O 2 :
0,1225.96000 = 11760 (đồng)
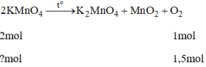
n K M n O 4 = 1,5 . 2 =3 mol
n K M n O 4 = 3.158 = 474 (g)
Số tiền mua 474g để điều chế 1,5 mol O 2 :
0,474.30000 = 14220(đồng)
Vậy để điều chế cùng 1 thể tích khí O 2 thì dùng K C l O 3 để điều chế kinh tế hơn mặc dù giá tiền cao mua 1 kg K C l O 3 cao hơn nhưng thể tích khí O 2 sinh ra nhiều hơn.
Đúng 0
Bình luận (0)
Lấy cùng một lượng K C l O 3 và K M n O 4 để điều chế oxi. Chất nào tạo ra nhiều khí O 2 hơn. Viết phương trình phản ứng và giải thích.
Giả sử ta lấy cùng một khối lượng là a g
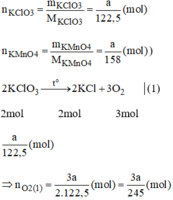
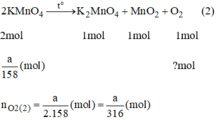
Vậy 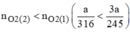 nên khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là
K
C
l
O
3
nên khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là
K
C
l
O
3
Đúng 0
Bình luận (0)
a) Để điều chế cùng lượng O2, ta dùng kclo3 hay kmno4 chất nào lợi hơn, vì sao? b) Để điều chế 11,2 lít O2(đktc) .Tính khối lượng kclo3, kmno4 đã dùng
PTHH :
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
1/3 0,5
\(2MnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
1 0,5
Vậy khi điều chế cùng lượng O2 ta dùng KClO3 lợi hơn vì với 1 mol KClO3 sẽ cho ra 1,5 mol O2 còn KMnO4 chỉ cho ra 0,5 mol O2
\(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(m_{KClO_3}=122,5.\dfrac{1}{3}=\dfrac{245}{6}\approx40,8\left(g\right)\)
\(m_{KMnO_4}=158.1=158\left(g\right)\)
Đúng 1
Bình luận (0)
Nếu lấy cùng một lượng (số mol) KClO3 và KMnO4 để điều chế khí oxygen thì chất nào sẽ cho nhiều khí oxygen hơn?
Giả sử ta lấy cùng một khối lượng là a gam
\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{a}{122,5}\left(mol\right)\)
\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{a}{158}\left(mol\right)\)
\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\) (1)
Theo phương trình:
\(n_{O_2\left(1\right)}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{2}.\dfrac{a}{122,5}=\dfrac{3a}{245}\)
\(2KMnO_4\xrightarrow[]{t^2}K_2MnO_4+MnO_2+O_2\) (2)
Theo phương trình:
\(n_{O_2\left(2\right)}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}.\dfrac{a}{158}=\dfrac{a}{316}\left(mol\right)\)
Ta thấy: \(\dfrac{a}{316}< \dfrac{a}{245}\)
\(\Rightarrow n_{O_2\left(2\right)}< n_{O_2\left(2\right)}\)
Vậy khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là KClO3
Đúng 1
Bình luận (0)
\(PTHH:2KClO_3\underrightarrow{to}2KCL+3O_2\uparrow\)
\(2KMnO_4\underrightarrow{to}K_2MnO_4+MnO_2+O_2\uparrow\)
Từ PTHH trên ta thấy đc rằng:
\(KClO_3\) sẽ điều chế khí oxygen nhiều hơn do phân huỷ nhiều Oxygen
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm có 2 chất KMnO4 và KClO3 là nguyên liệu để điều chế khí O2. Để điều chế được 3,36 lit khí O2(đktc) thì dùng chất nào sẽ cần khối lượng nhỏ nhất
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,3<------------------------------0,15
2KClO3 --to--> 2KCl + 3O2
0,1<-----------------0,15
=> \(\left\{{}\begin{matrix}m_{KMnO_4}=0,3.158=47,4\left(g\right)\\m_{KClO_3}=0,1.122,5=12,25\left(g\right)\end{matrix}\right.\)
=> Dùng KClO3 sẽ cần khối lượng nhỏ hơn
Đúng 1
Bình luận (1)
(giúp mình với nha)Lấy cùng 1 lượng KClO3 và KMnO4 để điều chế khí oxi, chất nào cho nhiều khí oxi hơn? Viết phương trình hóa học và giải thích
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
\(\dfrac{m}{122,5}\) \(\dfrac{3m}{245}\) ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
\(\dfrac{m}{158}\) \(\dfrac{m}{316}\) ( mol )
So sánh:
\(\dfrac{3m}{245}\) > \(\dfrac{m}{316}\)
=> \(KClO_3\) cho nhiều O2 hơn
Đúng 1
Bình luận (7)
lấy cùng một lượng KCLO3 và KMnO4 để điều chế khí O2.Chất nào cho nhiều khí O2 hơn
a, viết pt hoa hoc rồi giải thích
b. nếu điều chế thể tích khí o2 thì dùng chất nào kinh tế hơn
biết rằng giá KMnO4 là 30.000đ/kg và KCLO3 là 96.000đ/kg
a. PTHH: \(2KMnO_4\underrightarrow{to}K_2MnO_4+MnO_2+O_2\\ \dfrac{x}{158}mol\rightarrow\dfrac{x}{316}mol:\dfrac{x}{316}mol:\dfrac{x}{316}mol\)
\(2KClO_3\xrightarrow[to]{MnO_2}2KCl+3O_2\\ \dfrac{x}{122,5}\rightarrow\dfrac{x}{122,5}:\dfrac{3x}{245}\)
Gọi x là khối lượng của 2 chất.
\(\Rightarrow\left\{{}\begin{matrix}n_{KMnO_4}=\dfrac{x}{158}\\n_{KClO_3}=\dfrac{x}{122,5}\end{matrix}\right.\)
\(\dfrac{3x}{245}>\dfrac{x}{316}\)
Vậy nếu có cùng một lượng thì Kali Clorat nhiệt phân sẽ điều chế được nhiều Oxi hơn.
b. Nếu điều chế Oxi thì nên dùng Kali pemanganat hơn vì nó dễ kiếm và phù hợp với điều kiện kinh tế hơn.
Đúng 0
Bình luận (1)
a) lấy cùng một lượng KCLO3 và Kmno4 để điều chế khí O2. Chất nào cho nhiều khí O2.
b) nếu điều chế cùng một thể tích khí oxi thì dùng chất nào kinh tế hơn? Biết giá KCLO3 là 96.000₫/kg và Kmno4 là 30.000₫/kg
Gọi m KClO3 và m KMnO4=a
-->n KClO3=a/122,4
n KMnO4=a/158(mol)
2KClO3--->2KCl+3O2
a/122,5------------>a/81,667(mol)
2KMnO4---->K2MnO4+MnO2+O2
a/158--------------------------------a/316(mol)
\(\frac{a}{81,667}>\frac{a}{316}\)
-->KClO3 cho nhiều khí hơn
b)

- giả sử lấy 1 mol KClO3 và 1 mol KMnO4
PTHH: 2 KClO3 -to-> 2 KCl + 3 O2
1_________________1_______1,5(mol)
2 KMnO4 -to-> K2MnO4 + MnO2 + O2
1____________0,5__________0,5__0,5(mol)
Vì 1,5 > 0,5 => Nếu cùng 1 lượng KClO3 và KMnO4 thì lượng O2 điều chết từ KClO3 sẽ nhiều hơn.
b)
PTHH: 2 KClO3 -to-> 2 KCl + 3 O2
2/3_________________2/3_______1(mol)
2 KMnO4 -to-> K2MnO4 + MnO2 + O2
2____________1__________1__1(mol)
Ví dụ cùng 1 mol O2.
Ta có , số tiền mua KMnO4= 30 000 . (316/1000)=9480 (đồng)
số tiền mua KClO3= 96000.((245/3) /1000)= 7840(đồng)
Vì 9480>7840 nên nếu cùng 1 thể tích O2 thì dùng KMnO4 kinh tế hơn.























