hòa tan hoàn toàn 1.2g kim loại A có hóa trị II bằng 100ml dung dịch H2SO4 0.5M. kim loại A là gì

Những câu hỏi liên quan
Hòa tan hoàn toàn 12.8g 1 kim loại A hóa trị II ( A đứng sau H2O dãy hoạt động hóa học của kim loại) trong 27.78 ml dung dịch H2SO4 98% ( D1.8g/ml) đun nóng ta thu được dung dịch B và 1 khí C duy nhất. Trung hòa dung dịch B bằng 1 lượng NaOH 0.5M vừa đủ rồi cô cạn dung dịch ngậm được 82.2g chất rắn D gồm 2 muối Na2SO4 ngậm 10H2O và ASO4 ngậm xH2O sau khi làm khan 2 muối trên thu đươc chất rắn E có khối lượng 56,2%a) Xác định kim loại A và công thức ASO4 ngậm xH2Ob) Tính thể tích dung dịch đã dù...
Đọc tiếp
Hòa tan hoàn toàn 12.8g 1 kim loại A hóa trị II ( A đứng sau H2O dãy hoạt động hóa học của kim loại) trong 27.78 ml dung dịch H2SO4 98% ( D=1.8g/ml) đun nóng ta thu được dung dịch B và 1 khí C duy nhất. Trung hòa dung dịch B bằng 1 lượng NaOH 0.5M vừa đủ rồi cô cạn dung dịch ngậm được 82.2g chất rắn D gồm 2 muối Na2SO4 ngậm 10H2O và ASO4 ngậm xH2O sau khi làm khan 2 muối trên thu đươc chất rắn E có khối lượng = 56,2%
a) Xác định kim loại A và công thức ASO4 ngậm xH2O
b) Tính thể tích dung dịch đã dùng
Hòa tan hoàn toàn một oxit kim loại có hóa trị II bằng dung dịch
H
2
S
O
4
có nồng độ 14,00% vừa đủ thì thu được một dung dịch muối có nồng độ 16,22%. Oxit kim loại hóa trị II trên là A. FeO B. CuO C. MgO D. ZnO
Đọc tiếp
Hòa tan hoàn toàn một oxit kim loại có hóa trị II bằng dung dịch H 2 S O 4 có nồng độ 14,00% vừa đủ thì thu được một dung dịch muối có nồng độ 16,22%. Oxit kim loại hóa trị II trên là
A. FeO
B. CuO
C. MgO
D. ZnO
Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
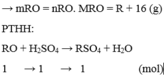
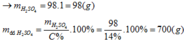
![]()
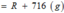
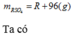

Vậy công thức của oxit kim loại là MgO
Đúng 0
Bình luận (0)
R là một kim loại có hóa trị II . Đem hòa tan hoàn toàn a gam oxit của kim loại này vào 48 gam dung dịch H2SO4 6,125 % làm tạo thành dung dịch A có chứa 0,98 % H2SO4 .Khi dùng 2,8 lít cacbon (II) oxit để khử hoàn toàn a gam oxit nói trên thành kim loại , thu được khí B.Nếu lấy 0,7l khí B (đktc) cho qua dung dịch nước vôi trong dư thấy tạo ra 0,625g kết tủa.Tính a và tìm kim loại R biết rằng các phản ứng xảy ra hoàn toàn
Đọc tiếp
R là một kim loại có hóa trị II . Đem hòa tan hoàn toàn a gam oxit của kim loại này vào 48 gam dung dịch H2SO4 6,125 % làm tạo thành dung dịch A có chứa 0,98 % H2SO4 .Khi dùng 2,8 lít cacbon (II) oxit để khử hoàn toàn a gam oxit nói trên thành kim loại , thu được khí B.Nếu lấy 0,7l khí B (đktc) cho qua dung dịch nước vôi trong dư thấy tạo ra 0,625g kết tủa.Tính a và tìm kim loại R biết rằng các phản ứng xảy ra hoàn toàn
Ban tham khao
R là một kim loại có hóa trị II, đem hòa tan hoàn toàn a gam oxit của kim loại này vào 48 gam dung dịch H2SO4 6,125% [đã giải] – Học Hóa Online
Đúng 0
Bình luận (0)
bài 1:cho 7,2g kim loại hóa trị II phản ứng hoàn toàn 100ml dung dịch HCL 6M. Xác định tên kim loại đã dùng
baì 2: hòa tan hoàn toàn 7,56g kim loại R có hóa trị III vào dung dịch axit HCL thu được 9,408 lít H2 (đktc). Tìm kim loại R
Giúp mik vs ạ ! Cảm ơn
Bài 1:
Gọi KL cần tìm là A.
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
Ta có: \(n_{HCl}=0,1.6=0,6\left(mol\right)\)
Theo PT: \(n_A=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy: KL cần tìm là Mg.
Đúng 1
Bình luận (0)
Bài 2:
PT: \(2R+6HCl\rightarrow2RCl_3+3H_2\)
Ta có: \(n_{H_2}=\dfrac{9,408}{22,4}=0,42\left(mol\right)\)
Theo PT: \(n_R=\dfrac{2}{3}n_{H_2}=0,28\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{7,56}{0,28}=27\left(g/mol\right)\)
Vậy: R là Al.
Đúng 1
Bình luận (0)
hòa tan hoàn toàn b (g) oxit kim loại có hóa trị II bằng 1 lượng vừa đủ dung dịch H2SO4 15,8% thu được dung dịch muối có nồng độ 22,959% . Xác định tên oxit kim loại
CT oxit : MO
Đặt số mol oxit phản ứng là 1 mol
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{15,8\%}=620,25\left(g\right)\)
\(m_{ddsaupu}=620,25+M+16=M+636,25\left(g\right)\)
Ta có : \(C\%_{MSO_4}=\dfrac{M+96}{M+636,25}.100=22,959\)
=> M=65 (Zn)
=> Oxit kim loại : ZnO (Kẽm oxit)
Đúng 3
Bình luận (0)
a) để hòa tan hoàn toàn 8 g oxit một kim loại R cần dùng 10,95 g HCl .hỏi R là kim loại gì ?
b) hòa tan hoàn toàn 1,44 g kim loại hóa trị 2 bằng dung dịch H2SO4 loãng chứa 7,35 g H2SO4 để phản ứng hết lượng dư axit người ta phải dùng 1,3 g NaOH sau phản ứng thu được muối Natrisunjat và nước . viết PTHH và xác định kim loại đem dùng
a) CT : R2On
nHCl = 10.95/36.5 = 0.3 (mol)
R2On + 2nHCl => 2RCln + nH2O
0.15/n_____0.3
M= 8/0.15/n = 160n/3
=> 2R + 16n = 160n3
=> 2R = 112n/3
BL : n 3 => R = 56
R là : Fe
b)2NaOH + H2SO4 => Na2SO4 + H2O
nH2SO4(bđ) = 7.36/98 = 0.075 (mol)
nNaOH = 1.3/40 = 0.0325 (mol)
=> nH2SO4(pư) = 0.075 - 0.0325/2 = 0.05875 (mol)
R + H2SO4 => RSO4 + H2
0.05875_0.05875
M = 1.44/0.05875= 24
R là : Mg
Chúc bạn học tốt !!!
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn một kim loại R có hóa trị II bằng dung dịch
H
2
SO
4
9,8% (loãng) vừa đủ, sau phản ứng thu được dung dịch X chứa muối Y với nồng độ phần trăm là 14,394%. Kim loại R là: A. Mg. B. Fe. C. Zn. D. Cu.
Đọc tiếp
Hòa tan hoàn toàn một kim loại R có hóa trị II bằng dung dịch H 2 SO 4 9,8% (loãng) vừa đủ, sau phản ứng thu được dung dịch X chứa muối Y với nồng độ phần trăm là 14,394%. Kim loại R là:
A. Mg.
B. Fe.
C. Zn.
D. Cu.
Hòa tan hoàn toàn 35,1 gam kim loại M hóa trị II trong dung dịch H2SO4 loãng dư, thu được 1,08 gam khí H2. Kim loại M là: A. Be. B. Mg. C. Zn. D. Ca.
Đọc tiếp
Hòa tan hoàn toàn 35,1 gam kim loại M hóa trị II trong dung dịch H2SO4 loãng dư, thu được 1,08 gam khí H2. Kim loại M là:
A. Be.
B. Mg.
C. Zn.
D. Ca.
Hòa tan hoàn toàn 14,40 gam kim loại M (hóa trị II) trong dung dịch H2SO4 loãng dư thu được 13,44 lít khí H2 (đktc). Kim loại M là
A. Be
B. Mg
C. Ca
D. Ba
Chọn B
Kim loại hóa trị II Þ nM = nH2 = 0,6 Þ MM = 14,4/0,6 = 24 (Mg).
Đúng 0
Bình luận (0)