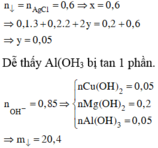Trộn dung dịch chứa 0,2 mol CuCl2 với dung dịch chứa 20(g) NaOH. Biết H = 80%. Tính khối lượng kết tủa thu được?

Những câu hỏi liên quan
Cho dung dịch chứa 0,2 mol CuCl2 tác dụng với 200 g dung dịch NaOH (vừa đủ) thu được kết tủa A và dung dịch B. Nung A đến khối lượng không đổi, được chất rắn C. a. Tính khối lượng kết tủa A và chất rắn C? b. Tính C% dung dịch NaOH đã dùng? c. Tính khối lượng chất tan trong dung dịch B?
PTHH: \(CuCl_2+2NaOH\rightarrow2NaCl+Cu\left(OH\right)_2\downarrow\)
\(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
Ta có: \(n_{CuCl_2}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Cu\left(OH\right)_2}=0,2\left(mol\right)=n_{CuO}\\n_{NaOH}=0,4\left(mol\right)=n_{NaCl}\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Cu\left(OH\right)_2}=0,2\cdot98=19,6\left(g\right)\\m_{CuO}=0,2\cdot80=16\left(g\right)\\m_{NaCl}=0,4\cdot58,5=23,4\left(g\right)\\C\%_{NaOH}=\dfrac{0,4\cdot40}{200}\cdot100\%=8\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Trộn 1 dung dịch có hòa tan 0,2 mol CuCl2 với dung dịch có hòa tan 20g NaOH, lọc tách được kết tủa và dung dịch trước nước lọc. Nung kết tủa đến khối lượng không đổi thu được a gam chất rắn a) Tính giá trị bằng số của a b) Tính khối lượng các chất có trong dung dịch nước lọc
a) \(n_{NaOH}=\dfrac{20}{40}=0,5\left(mol\right)\)
\(CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaCl\)
Lập tỉ lệ : \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\)=> Sau phản ứng NaOH dư
\(n_{Cu\left(OH\right)_2}=n_{CuCl_2}=0,2\left(mol\right)\)
Dung dịch nước lọc gồm NaCl (0,4_mol); NaOH dư ( 0,1 mol)
\(Cu\left(OH\right)_2-^{t^o}\rightarrow CuO+H_2O\)
\(n_{CuO}=n_{Cu\left(OH\right)_2}=0,2\left(mol\right)\)
\(a=m_{CuO}=0,2.80=16\left(g\right)\)
b) \(m_{NaCl}=0,4.58,5=23,4\left(g\right);m_{NaOH}=0,1.40=4\left(g\right)\)
Đúng 2
Bình luận (0)
trộn 40ml dung dịch có chứa 1,35 cucl2 vào 60ml dung dịch có chứa 0,4g NaOH .Sau phản ứng xong thu được kết tủa và nước lọc.Đem kết tủa đi nung đến khối lượng ko đổi a)viết pthh xảy ra b) tính khối lượng chất rắn thu được sau khi nung c)tính CM các chất trong nước lọc
a)
$CuCl_2 + 2NaOH \to Cu(OH)_2 + 2NaCl$
$Cu(OH)_2 \xrightarrow{t^o} CuO + H_2O$
b)
$n_{CuCl_2} = 0,01(mol) ; n_{NaOH} = 0,01(mol)$
Ta thấy :
$n_{CuCl_2} : 1 > n_{NaOH} : 2$ nên $CuCl_2$ dư
$n_{CuO} = n_{Cu(OH)_2} = \dfrac{1}{2}n_{NaOH} = 0,005(mol)$
$m_{CuO} = 0,005.80 = 0,4(gam)$
c) $V_{dd} = 0,04 + 0,06 = 0,1(lít)$
$n_{CuCl_2\ dư} = 0,01 - 0,005 = 0,005(mol)$
$n_{NaCl} = n_{NaOH} = 0,01(mol)$
$C_{M_{CuCl_2}} = \dfrac{0,005}{0,1} = 0,05M$
$C_{M_{NaCl}} = \dfrac{0,01}{0,1} = 0,1M$
Đúng 2
Bình luận (0)
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3-, x mol Cl-, y mol Cu2+ - Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa - Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là : A. 20,4 gam. B. 25,3 gam. C. 26,4 gam. D. 21,05 gam.
Đọc tiếp
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3-, x mol Cl-, y mol Cu2+
- Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa
- Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là :
A. 20,4 gam.
B. 25,3 gam.
C. 26,4 gam.
D. 21,05 gam.
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3–, x mol Cl–, y mol Cu2+. – Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa. – Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là A. 20,40 gam. B. 25,30 gam. C. 26,40 gam. D. 21,05 gam.
Đọc tiếp
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3–, x mol Cl–, y mol Cu2+.
– Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa.
– Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là
A. 20,40 gam.
B. 25,30 gam.
C. 26,40 gam.
D. 21,05 gam.
Đáp án A
● Bảo toàn nguyên tố Clo: x = nAgCl = 86,1 ÷ 143,5 = 0,6 mol.
Bảo toàn điện tích: y = (0,2 + 0,6 – 0,1 × 3 – 0,2 × 2) ÷ 2 = 0,05 mol.
► NaOH + X → ghép ion. Ghép 0,2 mol NaNO3 và 0,6 mol NaCl
||⇒ dư 0,05 mol Na+ ghép với AlO2– ⇒ còn 0,05 mol Al cho Al(OH)3.
► Kết tủa gồm 0,05 mol Al(OH)3; 0,2 mol Mg(OH)2; 0,05 mol Cu(OH)2.
||⇒ m↓ = 0,05 × 78 + 0,2 × 58 + 0,05 × 98 = 20,4(g)
Đúng 0
Bình luận (0)
Cho dung dịch X chứa 0,1 mol Al3+; 0,2 mol Mg2+; 0,2 mol NO3-; x mol Cl-; y mol Cu2+. Cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủA. Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là: A. 26,4 gam B. 25,3 gam C. 21,05 gam D. 20,4 gam
Đọc tiếp
Cho dung dịch X chứa 0,1 mol Al3+; 0,2 mol Mg2+; 0,2 mol NO3-; x mol Cl-; y mol Cu2+. Cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủA. Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là:
A. 26,4 gam
B. 25,3 gam
C. 21,05 gam
D. 20,4 gam
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3–, x mol Cl–, y mol Cu2+. – Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa. – Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là A. 20,40 gam B. 25,30 gam C. 26,40 gam D. 21,05 gam
Đọc tiếp
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3–, x mol Cl–, y mol Cu2+.
– Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa.
– Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là
A. 20,40 gam
B. 25,30 gam
C. 26,40 gam
D. 21,05 gam
Đáp án A
● Bảo toàn nguyên tố Clo: x = nAgCl = 86,1 ÷ 143,5 = 0,6 mol.
Bảo toàn điện tích: y = (0,2 + 0,6 – 0,1 × 3 – 0,2 × 2) ÷ 2 = 0,05 mol.
► NaOH + X → ghép ion. Ghép 0,2 mol NaNO3 và 0,6 mol NaCl
||⇒ dư 0,05 mol Na+ ghép với AlO2– ⇒ còn 0,05 mol Al cho Al(OH)3.
► Kết tủa gồm 0,05 mol Al(OH)3; 0,2 mol Mg(OH)2; 0,05 mol Cu(OH)2.
||⇒ m↓ = 0,05 × 78 + 0,2 × 58 + 0,05 × 98 = 20,4(g)
Đúng 0
Bình luận (0)
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3–, x mol Cl–, y mol Cu2+. – Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa. – Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là A. 20,40 gam B. 25,30 gam C. 26,40 gam D.21,05 gam
Đọc tiếp
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3–, x mol Cl–, y mol Cu2+.
– Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa.
– Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là
A. 20,40 gam
B. 25,30 gam
C. 26,40 gam
D.21,05 gam
Đáp án A
● Bảo toàn nguyên tố Clo:
x = nAgCl = 86,1 ÷ 143,5 = 0,6 mol.
Bảo toàn điện tích: y = (0,2 + 0,6 – 0,1 × 3 – 0,2 × 2) ÷ 2 = 0,05 mol.
► NaOH + X → ghép ion.
Ghép 0,2 mol NaNO3 và 0,6 mol NaCl
||⇒ dư 0,05 mol Na+ ghép với AlO2–
⇒ còn 0,05 mol Al cho Al(OH)3.
► Kết tủa gồm 0,05 mol Al(OH)3; 0,2 mol Mg(OH)2; 0,05 mol Cu(OH)2.
||⇒ m↓ = 0,05 × 78 + 0,2 × 58 + 0,05 × 98 = 20,4(g)
Đúng 0
Bình luận (0)
Cho dung dịch X chứa 0,1 mol Al3+; 0,2 mol Mg2+; 0,2 mol NO3-; x mol Cl-; y mol Cu2+. Cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủA. Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là: A. 26,4 gam. B. 25,3 gam. C. 21,05 gam. D. 20,4 gam.
Đọc tiếp
Cho dung dịch X chứa 0,1 mol Al3+; 0,2 mol Mg2+; 0,2 mol NO3-; x mol Cl-; y mol Cu2+. Cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủA. Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là:
A. 26,4 gam.
B. 25,3 gam.
C. 21,05 gam.
D. 20,4 gam.