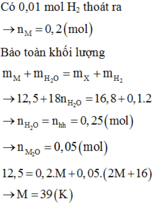cho 4,6 gam hỗn hợp gồm kali và một kim loại kiềm khác vào 250ml được dung dịch A và 2,24 lít H2 xác định kim loại kiềm đó

Những câu hỏi liên quan
Cho 4,6 gam kim loại kiềm tan hoàn toàn vào 95,6 gam nước thì thu được 2,24 lít khí H2 ở đktc và dung dịch X . Kim loại kiềm và C% của dung dịch X là ? ( Biết Na = 23 ; K = 39 ; Li = 7 ; H = 1 ; O = 16 )
Gọi kl kiềm là A.
A + H2O -> AOH + 1/2 2
nH2= 0,1(mol) -> nA=0,2(mol)
=>M(A)=mA/nA=4,6/0,2=23(g/mol)
->A là Natri (Na=23)
PTHH: Na + H2O -> NaOH + 1/2 H2
0,2_____________0,2________0,1(mol)
mNaOH=0,2.40=8(g)
mddNaOH=mNa+ mH2O - mH2= 4,6+95,6-0,1.2=100(g)
-> C%ddNaOH= (8/100).100=8%
Đúng 1
Bình luận (0)
Bài 7: Hỗn hợp gồm một kim loại kiềm (hóa trị I) và oxit của nó có khối lượng 19,3 gam tan hết trong nước thoát ra 3,36 lít H2 (đktc) và thu được một dung dịch kiềm. Để trung hòa dung dịch kiềm này cần dùng hết 350 ml H2SO4 1M. Xác định kim loại kiềm.Bài 8: Một hỗn hợp gồm Zn và Fe có khối lượng là 30,7 gam. Hòa tan hỗn hợp này trong 400 ml dung dịch H2SO4 2M.a/ Chứng tỏ rằng hỗn hợp này tan hết.b/ Nếu dùng một lượng hỗn hợp Zn và Fe gấp đôi trường hợp trước, lượ...
Đọc tiếp
Bài 7: Hỗn hợp gồm một kim loại kiềm (hóa trị I) và oxit của nó có khối lượng 19,3 gam tan hết trong nước thoát ra 3,36 lít H2 (đktc) và thu được một dung dịch kiềm. Để trung hòa dung dịch kiềm này cần dùng hết 350 ml H2SO4 1M. Xác định kim loại kiềm.
Bài 8: Một hỗn hợp gồm Zn và Fe có khối lượng là 30,7 gam. Hòa tan hỗn hợp này trong 400 ml dung dịch H2SO4 2M.
a/ Chứng tỏ rằng hỗn hợp này tan hết.
b/ Nếu dùng một lượng hỗn hợp Zn và Fe gấp đôi trường hợp trước, lượng H2SO4 vẫn như cũ thì hỗn hợp mới này có tan hết hay không?
c/ Trong trường hợp (a), hãy tính khối lượng mỗi kim loại trong hỗn hợp biết rằng khi đốt cháy lượng H2 sinh ra trong phản ứng, thì thu được 8,1 gam nước (lượng nước bị hao hụt 10%).
Trộn 10,92g kim loại K vào 17,6 gam hỗn hợp X gồm một kim loại kiềm và một kim loại kiềm thổ được hỗn hợp Y, phần trăm khối lượng của K có trong Y là 51,964%. Lấy toàn bộ Y cho vào dung dịch HCl dư thu được dung dịch A và 6,496 lít H2 (đktc)
a, Tìn kim loại kiềm và kim loại kiềm thổ có trong X?
b, Tính khối lượng mỗi muối trong dung dịch A?
Xem chi tiết
Hòa tan hết 12,5 gam hỗn hợp gồm M và M2O (M là kim loại kiềm) vào nước thu được dung dịch X chứa 16,8 gam chất tan và 2,24 lít khí H2 (đktc). Kim loại M là
A. Na
B. Rb
C. K
D. Li
Hòa tan hoàn toàn 42,6 gam hỗn hợp X gồm một kim loại kiềm và một kim loại kiềm thổ có tỉ lệ mol tương ứng là 5 : 4 vào 500 ml dung dịch HCl 1M thu được dung dịch Y và 17,472 lít khí (đktc).a) Xác định thành phần % về khối lượng mỗi kim loại trong X.b) Dẫn từ từ khí CO2 vào dung dịch Y, tính thể tích khí CO2 (đktc) cần dùng để thu được lượng kết tủa lớn nhất.
Đọc tiếp
Hòa tan hoàn toàn 42,6 gam hỗn hợp X gồm một kim loại kiềm và một kim loại kiềm thổ có tỉ lệ mol tương ứng là 5 : 4 vào 500 ml dung dịch HCl 1M thu được dung dịch Y và 17,472 lít khí (đktc).
a) Xác định thành phần % về khối lượng mỗi kim loại trong X.
b) Dẫn từ từ khí CO2 vào dung dịch Y, tính thể tích khí CO2 (đktc) cần dùng để thu được lượng kết tủa lớn nhất.
cho 6,2 gam hỗn hợp X gồm hai kim loại kiềm thuộc chu kỳ liên tiếp nhau vào 200g nước (dùng dư ),thu được 2,24 lít khí (đktc) và dung dịch Y.
a. Xác định tên hai kim loại trên.
b. Tính %m mỗi kim loại có trong X
c. Tính nồng độ % các chất tan trong dung dịch Y
Cho 13,8 gam hỗn hợp X gồm kim loại kiềm R và Ca tác dụng hết với nước thu được 5,6 lít H2 (đktc) và dung dịch Y. Mặt khác, cho 8,58 gam kim loại R phản ứng hết với lượng dư dung dịch HCl thì thể tích khí H2 thoát ra lớn hơn 2,24 lít (đktc). 1. Tìm kim loại R? 2. Cho 15 lít hỗn hợp khí Z gồm N2 và CO2 (đktc) vào dung dịch Y. Sau khi phản ứng kết thúc thu được 8,5 gam kết tủa. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp Z?
Đọc tiếp
Cho 13,8 gam hỗn hợp X gồm kim loại kiềm R và Ca tác dụng hết với nước thu được 5,6 lít H2 (đktc) và dung dịch Y. Mặt khác, cho 8,58 gam kim loại R phản ứng hết với lượng dư dung dịch HCl thì thể tích khí H2 thoát ra lớn hơn 2,24 lít (đktc).
1. Tìm kim loại R?
2. Cho 15 lít hỗn hợp khí Z gồm N2 và CO2 (đktc) vào dung dịch Y. Sau khi phản ứng kết thúc thu được 8,5 gam kết tủa. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp Z?
1.
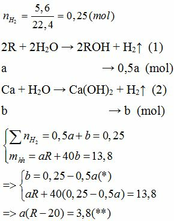
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
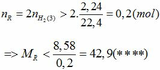
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
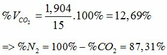
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
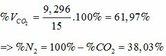
Đúng 0
Bình luận (0)
Cho 10g hỗn hợp lại kim loại kiềm tan hoàn toàn vào 100ml H2O( d = 1g / ml ) thu được dung dịch A và 2,24 lít khí ( đkc ) . Xác định 2 kim loại và tính khối lượng dung dịch A là
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
VH2O = 100ml => mH2O = 100g ( do d = 1g/ml)
Áp dụng ĐLBTKL:
\(m_A=10+100-0,1.2=109,8\left(g\right)\)
Phải có thêm dữ kiện mới xác định được 2 KL nhé
Đúng 0
Bình luận (0)
Bổ sung cho dễ làm: "2 kim loại kiềm ở 2 chu kì liên tiếp"
Tiếp tục với bài của bạn Phạm Vũ Trí Dũng
Gọi công thức chung của 2 kim loại là R
PTHH: \(R+H_2O\rightarrow ROH+\dfrac{1}{2}H_2\uparrow\)
Theo PTHH: \(n_R=2n_{H_2}=0,2mol\) \(\Rightarrow\overline{M}_R=\dfrac{10}{0,2}=50\)
Vì \(39< \overline{M}_R< 85,5\) \(\Rightarrow\) Kim loại cần tìm là Rb và K
Đúng 0
Bình luận (0)
Cho a gam kim loại kiềm tác dụng với dung dịch HCL dư thu được 11,7gam muối và 2,24 lít khí H2 đktc .Xác định tên kim loại và tính giá trị a
\(\text{Đ}\text{ặt}:A\\ A+HCl\rightarrow ACl+H_2\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ n_A=n_{ACl_2}=2.n_{H_2}=0,1.2=0,2\left(mol\right)\\ M_{ACl}=\dfrac{11,7}{0,2}=58,5\left(\dfrac{g}{mol}\right)\\ M\text{à}:M_{ACl}=M_A+35,5\\ \Rightarrow M_A=23\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Natri\left(Na\right)\\ a=23.0,2=4,6\left(g\right)\)
Đúng 3
Bình luận (0)
nH2=2,24/22,4=0,1(mol)
2M+2HCl→2MCl+H2
0,2 ← 0,2 ← 0,1
Có 0,2 .(M+35,5)=11,7(gam)
⇒ M=23 ⇒M là Na
mNa=23. 0,2= 4,6 (gam)
Đúng 0
Bình luận (0)