Clo có hai đồng vị là \(^{35}_{17}\)Cl; \(^{37}_{17}\)Cl. Tỉ số nguyên tử của hai đồng vị này là 3:1. Tính nguyên tử lượng trung bình của Clo

Những câu hỏi liên quan
Clo có nguyên tử khối trung bình là 35,45. Hỏi có bao nhiêu nguyên tử của đồng vị Cl 17 35 trong 100 ml dung dịch HCl 0,1M?
Biết: Clo chỉ có hai đồng vị Cl 17 35 và Cl 17 37 ; số Avogadro N = 6,02.10^23
Câu 8: Trong tự nhiên, nguyên tố clo có 2 đồng vị \(^{35}_{17}Cl;^{37}_{17}Cl\) có % số nguyên tử tương ứng là 75% và 25%. Nguyên tố đồng có 2 đồng vị, trong đó \(^{63}_{29}Cu\) chiếm 73% số nguyên tử. Đồng và clo tạo được hợp chất CuCl2 trong đó % khối lượng Cu chiếm 47,228%. Tìm số khối của đồng vị còn lại của đồng.
+) Ta có:A¯Cl=35,75+37,25\100=35,5
+) Gọi a là số khối trung bình của Cu
=>%mCu=a\a+35,5.2.100%=47,228%=>a=63,54%
+) Đồng vị 63Cu chiếm 73% => đồng vị còn lại có số khối là x chiếm 27%
=>(63.73+x.27)\100=63,54=>x=65
Vậy đồng vị còn lại là 65Cu
Đúng 1
Bình luận (0)
Câu 8:Trong tự nhiên, nguyên tố clo có 2 đồng vị ^{35}_{17}Cl,^{37}_{17}Cl có % số nguyên tử tương ứng là 75% và 25%. Nguyên tố đồng có 2 đồng vị, trong đó ^{63}_{29}CuCuchiếm 73% số nguyên tử. Đồng và clo tạo được hợp chất CuCl2 trong đó % khối lượng Cu chiếm 47,228%. Tìm số khối của đồng vị còn lại của đồng.
Đọc tiếp
Câu 8:Trong tự nhiên, nguyên tố clo có 2 đồng vị \(^{35}_{17}Cl,^{37}_{17}Cl\) có % số nguyên tử tương ứng là 75% và 25%. Nguyên tố đồng có 2 đồng vị, trong đó \(^{63}_{29}Cu\)Cuchiếm 73% số nguyên tử. Đồng và clo tạo được hợp chất CuCl2 trong đó % khối lượng Cu chiếm 47,228%. Tìm số khối của đồng vị còn lại của đồng.
1.Trong các hợp chất thiên nhiên, nguyên tố clo gồm 2 đồng vị 35 17 Cl và 37 17 Cl; khối lượng nguyên tử trung bình của clo là 35, 5. Tính thành phần phần trăm các đồng vị của clo. 2.Trong một bình kín chứa 10lít nitơ và 10 lít hiđro ở nhiệt độ OoC và áp suất 10 atm. Sau phản ứng tổng hợp amoniac, đưa nhiệt độ về OoC . Tính áp suất trong bình sau phản ứng, biết rằng có 60% hiđro tham gia phản ứng.
Đọc tiếp
1.Trong các hợp chất thiên nhiên, nguyên tố clo gồm 2 đồng vị 35 17 Cl và 37 17 Cl; khối lượng nguyên tử trung bình của clo là 35, 5. Tính thành phần phần trăm các đồng vị của clo. 2.Trong một bình kín chứa 10lít nitơ và 10 lít hiđro ở nhiệt độ OoC và áp suất 10 atm. Sau phản ứng tổng hợp amoniac, đưa nhiệt độ về OoC . Tính áp suất trong bình sau phản ứng, biết rằng có 60% hiđro tham gia phản ứng.
Nguyên tử khối trung bình của Clo là 35,5. Clo trong tự nhiên có hai đồng vị là 35 Cl và 37 Cl. Tính phần trăm về khối lượng của 37 Cl chứa trong HClO4 (với Hidro đồng vị là 1 H, oxi đồng vị là 16 O)
\(\%^{35}Cl=x\%\Rightarrow\%^{37}Cl=\left(100-x\right)\%\)
\(\overline{M}=\dfrac{35x+37\cdot\left(100\%-x\right)}{100\%}=35.5\left(g\text{/}mol\right)\)
\(\Rightarrow x=75\%\)
\(\%^{37}Cl_{\left(HClO_4\right)}=\dfrac{25\%\cdot37}{1+35.5+16\cdot4}\cdot100\%=9.2\%\)
Đúng 3
Bình luận (1)
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có:
, vậy x = 75%.
Phần trăm khối lượng của 37Cl trong HClO4=
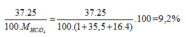
Đúng 1
Bình luận (2)
Clo có hai đồng vị bền : 3517Cl và 3717Cl . Nguyên tử khối trung bình của clo là 35 , 5 . Tính thành phần phần trăm số nguyên tử của mỗi đồng vị .
HELP ME !!!!!!
Tính thể tích (đktc) của 3,55g nguyên tố Clo, biết Clo có hai đồng vị \(^{35}_{17}Cl\) chiếm 75,53%; \(^{37}_{17}Cl\) chiếm 24,47%
Bài 5. Clo có hai đồng vị là 3537 1717;ClCl . Tỉ lệ % số nguyên tử của hai đồng vị là 3 : 1. a. Tính NTKTB của Clo? b. Tính thành phần % khối lượng của 35 Cl trong HClO 4 ? (H =1, O = 16). c. Tính số nguyên tử của 37 Cl trong 200 ml dung dịch MgCl 2 2M (Mg =24)? d. Tính số nguyên tử của 35 Cl trong 4,48 lít khí HCl (đkc)? (H = 1)
30. Nguyên tố Clo trong tự nhiên gồm 2 đồng vị bền là 1735Cl và 3717Cl, biết rằng 7,108 gam khí Clo chiếm thể tích 2,24 lít (đktc). Xác định thành phần % về số mol của các đồng vị 1735Cl và 1737Cl lần lượt là?















