Bột sulfur (S) có màu vàng, bột iron (Fe) có màu xám. Nếu trộn một phần bột iron và một phần bột sulfur thì hỗn hợp ngả sang màu xám vàng. Nếu trộn ba phần bột iron và một phần bột sulfur thì hỗn hợp chủ yếu ngả sang màu nào?

Những câu hỏi liên quan
Điều kiện để phản ứng xảy ra giữa bột sắt (iron) Fe và bột lưu huỳnh (sulfur) S là
Thí nghiệm: Sulfur tác dụng với sắt (iron)Chuẩn bị: bột sulfur, bột iron, ống nghiệm, kẹp gỗ, đèn cồn, bông.Tiến hành:- Trộn đều bột sulfur với bột iron theo tỉ lệ khối lượng khoảng 1 : 1,5.- Lấy khoảng 2 g hỗn hợp vào ống nghiệm khô chịu nhiệt, dùng bông nút miệng ống nghiệm.- Hơ nóng đều nửa dưới ống nghiệm trên ngọn lửa đèn cồn, sau đó đun tập trung vào phần chứa hỗn hợp.Quan sát, mô tả hiện tượng và thực hiện yêu cầu sau:Dự đoán sản phẩm tạo thành sau thí nghiệm, viết phương trình hoá học củ...
Đọc tiếp
Thí nghiệm: Sulfur tác dụng với sắt (iron)
Chuẩn bị: bột sulfur, bột iron, ống nghiệm, kẹp gỗ, đèn cồn, bông.
Tiến hành:
- Trộn đều bột sulfur với bột iron theo tỉ lệ khối lượng khoảng 1 : 1,5.
- Lấy khoảng 2 g hỗn hợp vào ống nghiệm khô chịu nhiệt, dùng bông nút miệng ống nghiệm.
- Hơ nóng đều nửa dưới ống nghiệm trên ngọn lửa đèn cồn, sau đó đun tập trung vào phần chứa hỗn hợp.
Quan sát, mô tả hiện tượng và thực hiện yêu cầu sau:
Dự đoán sản phẩm tạo thành sau thí nghiệm, viết phương trình hoá học của phản ứng và xác định chất oxi hoá, chất khử.
Hỗn hợp gồm 1 phần bột sắt với một phần bột lưu huỳnh có màu xám vàng. Nếu trộn ba phần bột sắt với một phần bột lưu huỳnh, hỗnợp sẽ thu được màu gì? Để tách bột sắt ra khỏi hỗn hợp voiuws lưu huỳnh ta dùng cách nao
Trộn 10,8 gam bột AIumnium (AI) với bột Sulfur (S) dư . Cho hỗn hợp vào ống nghiệm và đun nóng để phản ứng xảy ra ta thu được 25,5 gam Al2S3 . Tính hiệu suất phản ứng ?
\(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
PT: \(2Al+3S\underrightarrow{t^o}Al_2S_3\)
Theo PT: \(n_{Al_2S_3\left(LT\right)}=\dfrac{1}{2}n_{Al}=0,2\left(mol\right)\)
\(\Rightarrow m_{Al_2S_3\left(LT\right)}=0,2.150=30\left(g\right)\)
\(\Rightarrow H=\dfrac{25,5}{30}.100\%=85\%\)
Đúng 0
Bình luận (0)
Trộn 10,8 gam bột aluminium với bột sulfur dư. Cho hỗn hợp vào ống nghệm và đun nóng để phản ứng xảy ra thu được 25,5 gam Al2S3. Tính hiệu suất phản ứng?
\(n_{Al_2S_3\left(TT\right)}=\dfrac{25,5}{150}=0,17\left(mol\right)\\ n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\\ 2Al+3S\rightarrow\left(t^o\right)Al_2S_3\\ Ta,có:n_{Al_2S_3\left(LT\right)}=\dfrac{1}{2}n_{Al}=\dfrac{0,4}{2}=0,2\left(mol\right)\\ H=\dfrac{0,17}{0,2}.100\%=85\%\)
Đúng 3
Bình luận (0)
Có 10 g hỗn hợp bột kim loại copper và Iron Hãy giới thiệu phương pháp xác định thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp
Cho năm châm qua hỗn hợp kim loại, bột kim loại Iron bị năm châm hút còn lại bột kim loại Copper.
Cân bột Iron lên rồi lấy khối lượng bột Iron chia cho khối lượng hỗn hợp kim loại rồi nhân cho 100% ta được phầm trăm theo khối lượng của Iron trong hỗn hợp ban đầu.
Lấy 100% trừ cho phầm trăm theo khối lượng của Iron trong hỗn hợp ban đầu ta thu được phầm trăm theo khối lượng của Copper trong hỗn hợp ban đầu.
Đúng 2
Bình luận (0)
Câu 6. Học sinh A tiến hành thí nghiệm đốt cháy sulfur với bột sắt như sau:
Bước 1: lấy thìa nhỏ bột sắt và thìa nhỏ bột sulfur, trộn đều và cho vào ống nghiệm. Nút ống nghiệm bằng bông.
Săn SALE Shopee ngay thôi
Bước 2: Đun nóng ống nghiệm có chứa hỗn hợp trên ngọn lửa đèn cồn đến khi có đốm sáng xuất hiện trong ống nghiệm thì ngừng đun, tắt đèn cồn.
Phát biểu nào sau đây không đúng?
A. Sau bước 1, chưa thấy hiện tượng gì xảy ra.
B. Sau bước 2, thấy hỗn hợp cháy sáng, k...
Đọc tiếp
Câu 6. Học sinh A tiến hành thí nghiệm đốt cháy sulfur với bột sắt như sau: Bước 1: lấy thìa nhỏ bột sắt và thìa nhỏ bột sulfur, trộn đều và cho vào ống nghiệm. Nút ống nghiệm bằng bông. Săn SALE Shopee ngay thôi Bước 2: Đun nóng ống nghiệm có chứa hỗn hợp trên ngọn lửa đèn cồn đến khi có đốm sáng xuất hiện trong ống nghiệm thì ngừng đun, tắt đèn cồn. Phát biểu nào sau đây không đúng? A. Sau bước 1, chưa thấy hiện tượng gì xảy ra. B. Sau bước 2, thấy hỗn hợp cháy sáng, kết thúc phản ứng hỗn hợp chuyển thành chất bột màu đen. C. Sản phẩm tạo thành sau bước 2 là muối iron (III) sulfide. D. Phương trình phản ứng xảy ra ở
Câu 6. Học sinh A tiến hành thí nghiệm đốt cháy sulfur với bột sắt như sau:
Bước 1: lấy thìa nhỏ bột sắt và thìa nhỏ bột sulfur, trộn đều và cho vào ống nghiệm. Nút ống nghiệm bằng bông.
Bước 2: Đun nóng ống nghiệm có chứa hỗn hợp trên ngọn lửa đèn cồn đến khi có đốm sáng xuất hiện trong ống nghiệm thì ngừng đun, tắt đèn cồn.
Phát biểu nào sau đây không đúng?
A. Sau bước 1, chưa thấy hiện tượng gì xảy ra.
B. Sau bước 2, thấy hỗn hợp cháy sáng, kết thúc phản ứng hỗn hợp chuyển thành chất bột màu đen.
C. Sản phẩm tạo thành sau bước 2 là muối iron (III) sulfide.
D. Phương trình phản ứng xảy ra ở
Đúng 2
Bình luận (0)
Quan sát cốc đựng hỗn hợp sulfur và nước, hãy cho biết bột sulfur có tan trong nước không?
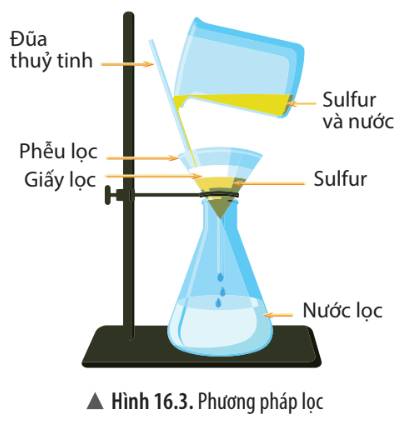
Bột sulfur không tan trong nước vì khi lọc tách riêng được bột sunfua khỏi nước.
Đúng 0
Bình luận (0)
Đun nóng mạnh hỗn hợp gồm 28 bột sắt và 20g bột lưu huỳnh thu đc 44g FeS màu xám
a) Viết PTHH
b) ms phản ứng = ?
PTHH:Fe+S->FeS
Nếu phản ứng vừa đủ->mFeS=mFe+mS=28+20=48(g)
Nhưng theo đề bài:mFeS=44(g)
-> phản ứng có chất dư
nFeS=0.5(mol)
theo pthh:nS:nFeS=1->nS phản ứng:0.5(mol)
mS phản ứng:0.5*32=16(g)
Đúng 0
Bình luận (2)
























