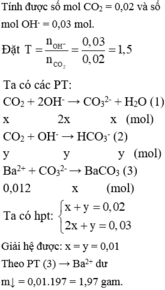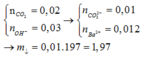Dẫn 4,48l hỗn hợp N2 và CO2 (đktc) vào 100ml dung dịch Ba(OH)2 1M Thu được 19,7 gam kết tủa Tính % thể tích mỗi khí trong hỗn hợp

Những câu hỏi liên quan
Tính thể tích khí so2 đã hấp thụ vào a) 100ml dung dịch Ca(OH)2 0,05M đẻ tạo được 0,3 gam kết tủa b) 200ml dung dịch hỗn hợp NaOH 2M và Ba(OH)2 1M, được 29,55 gam kết tủa c) 200ml dung dịch hỗn hợp NaOH 2M và Ba(OH)2 1M, được 39,4 gam kết tủa
Xem chi tiết
Dẫn 1 lít hỗn hợp khí X gồm N2 và CO2 (đktc) đi chậm qua 2 lít dung dịch Ca(OH)2 0,01 M thu được 1g kết tủa. Tính thể tích của N2 và CO2 trong X
nCa(OH)2 = 2.0,01 = 0,02 (mol)
\(n_{CaCO_3}=\dfrac{1}{100}=0,01\left(mol\right)\)
TH1: Nếu kết tủa không bị hòa tan
PTHH: Ca(OH)2 + CO2 --> CaCO3 + H2O
0,01<----0,01
=> \(\left\{{}\begin{matrix}V_{CO_2}=0,01.22,4=0,224\left(l\right)\\V_{N_2}=1-0,224=0,776\left(l\right)\end{matrix}\right.\)
TH2: Nếu kết tủa bị hòa tan 1 phần
PTHH: Ca(OH)2 + CO2 --> CaCO3 + H2O
0,02---->0,02------>0,02
CaCO3 + CO2 + H2O --> Ca(HCO3)2
0,01--->0,01
=> VCO2 = (0,02 + 0,01).22,4 = 0,672 (l)
=> VN2 = 1 - 0,672 = 0,328 (l)
Đúng 1
Bình luận (0)
Dẫn 4,48 lít hỗn hợp N2 và CO2 (đktc) vào 100 ml dung dịch Ba(OH)2 1M thu được 19,7 gam kết tủa .Tính % thể tích mỗi khí trong hỗn hợp .
Ba(OH)2 + CO2 \(\rightarrow\)BaCO3 + H2O
nBa(OH)2=0,1.1=0,1(mol)
nBaCO3=\(\dfrac{19,7}{197}=0,1\left(mol\right)\)
Vì 0,1=0,1 nên tác dụng vừa đủ
Theo PTHH ta có:
nBaCO3=nCO2=0,1(mol)
VCO2=22,4.0,1=2,24(lít)
%VCO2=\(\dfrac{2,24}{4,48}.100\%=50\%\)
%VN2=100-50=50%
Đúng 0
Bình luận (0)
Cho 10 lít (đktc) hỗn hợp khí gồm N2 và CO2 tác dụng với 2 lít dung dịch Ca(OH)2 0,02 mol/l thu được 1 gam kết tủa. Thành phần % theo thể tích N2 trong hỗn hợp ban đầu là: A. 2,24% hoặc 84,32% B. 2,24% hoặc 15,68% C. 15,68% hoặc 97,76% D. 84,32% hoặc 97,76%
Đọc tiếp
Cho 10 lít (đktc) hỗn hợp khí gồm N2 và CO2 tác dụng với 2 lít dung dịch Ca(OH)2 0,02 mol/l thu được 1 gam kết tủa. Thành phần % theo thể tích N2 trong hỗn hợp ban đầu là:
A. 2,24% hoặc 84,32%
B. 2,24% hoặc 15,68%
C. 15,68% hoặc 97,76%
D. 84,32% hoặc 97,76%
Đáp án D
Ta có nCa(OH)2= 2.0,02= 0,04 mol; nCaCO3= 1/100= 0,01 mol
Ta có nCa(OH)2 > nCaCO3 nên có 2 trường hợp:
- TH1: Ca(OH)2 dư
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
Theo PT (1): nCaCO3= nCO2= 0,01 mol →VCO2=0,01.22,4=0,224 lít
→%VCO2= 2,24%→ %VN2= 100%- 2,24%=97,76%
- TH2: Ca(OH)2 phản ứng hết:
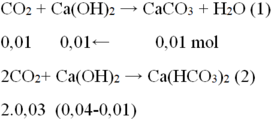
Ta có: nCO2= 0,01+ 2.0,03= 0,07 mol →VCO2= 0,07.22,4=1,568 lít
→%VCO2= 15,68%→ %VN2= 100%- 15,68%=84,32%
Đúng 0
Bình luận (0)
Hấp thụ hoàn toàn 11,2 lít (đktc) khí CO2 vào 200 ml hỗn hợp KOH a M và Ba (OH)2 1M sau pứ hoàn toàn thu được 19,7 gam kết tủa .Tính a.
Bài này làm ntn nào vậy ạ ???????!!!!!!
nBaCO3=0,1(mol) ; nCo2=0,5(mol)
nBa2+=0,2(mol);nOH-=0,4+0,2a(mol)
nkết tủa theo Ba2+=0,2 mol >nBa thực tế nên kết tủa tan một phần
Ba(oh)2+co2-->Baco3+h2o
0,2---------0,2------0,2
KOH+co2-->KHco3
0,2a---0,2a----0,2a
Baco3+h2o +co2-->Ba(hco3)2
0,1-------------0,1
từ đó nco2=0,3+0,2a=0,5---->a=1M
tư
Đúng 1
Bình luận (0)
Hấp thụ hoàn toàn 11,2 lít (đktc) khí CO2 vào 200 ml hỗn hợp KOH a M và Ba (OH)2 1M sau pứ hoàn toàn thu được 19,7 gam kết tủa .Tính a.
Bài này làm ntn nào vậy ạ ???????!!!!!!
$n_{BaCO_3} = 0,1(mol) \Rightarrow n_{CO_3^{2-}} = n_{BaCO_3} = 0,1(mol)$
$n_{CO_2} = \dfrac{11,2}{22,4} = 0,5(mol)$
Suy ra : $n_{HCO_3^-} = 0,5 - 0,1 = 0,4(mol)$
Mà :
$n_{OH^-} = 2n_{CO_3^{2-}} + n_{HCO_3^-} = 0,1.2 + 0,4 = 0,6(mol)$
Suy ra: $0,6 = 0,2a + 0,2.1.2 \Rightarrow a = 1(M)$
Đúng 2
Bình luận (0)
Cho 10 lít hỗn hợp khí N2 và CO2 (đktc) đi qua 2 lít dung dịch Ca(OH)2 0,02M thu được 1g kết tủa. Xác định thành phần % theo thể tích của CO2 trong hỗn hợp.
Số mol Ca(OH)2 = 2.0,02 = 0,04 mol
Số mol Ca(OH)2 = 2.0,02 = 0,04 mol
Số mol CaCO3 = 1_100=0,01 mol
Bài toán này có thể là 1 trong 2 trường hợp sau:
TH1: Số mol CO2 không đủ tác dụng với số mol Ca(OH)2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Số mol CO2 = số mol CaCO3 =0,01 mol
=>Thể tích CO2 = 22,4.0,01=0,224 lít
Vậy %thể tích CO2 = (0,224.100)/10=2,24%
TH2: Số mol CO2 nhiều hơn số mol Ca(OH)2 tham gia phản ứng:
CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
CaCO3 + CO2 + H2O → Ca(HCO3)2 (2)
Theo (1): số mol CO2 (1) = số mol CaCO3 = Số mol Ca(OH)2 = 0,04 mol
Ta có: Số mol CaCO3 (2) = 0,04-0,01 = 0,03 (mol)
Theo (2): Số mol CO2(2) = số mol CaCO3 (2) = 0,03 (mol)
Vậy tổng số mol CO2 phản ứng (1) và (2) là 0,04 + 0,03 = 0,07 mol
Do đó %thể tích CO2 = (0,07.22,4.100)/10 = 15,68%
Đúng 1
Bình luận (0)
Sục 0,448 lít khí C O 2 (đktc) vào 100ml dung dịch hỗn hợp B a ( O H ) 2 0,12M và KOH 0,06M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Tính giá trị của m.
Cho 0,448 lít khí CO2 (ở đktc) hấp thụ hết vào 100ml dung dịch chứa hỗn hợp NaOH 0,06M và Ba(OH)2 0,12M, thu được m gam kết tủa. Giá trị của m là
A. 1,182
B. 3,940
C. 1,970
D. 2,364