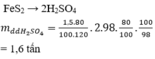Từ 80 tấn quặng FeS2 chứa 40o/oS sản xuất được 92 tấn H2SO4 a) tính hiệu suất của quá trình sản xuất b) từ 92 tấn H2SO4 có thể pha chế thành bao nhiêu tấn dd H2SO4 23O/O

Những câu hỏi liên quan
trong công nghiệp để sản xuất được 58,8 tấn h2so4 phải dùng 80 tấn quặng pirit chứa 75% FeS2 .Tính hiệu suất của quá trình sản xuất H2SO4 (Please!! Help me)
Từ 1,2 tấn quặng pillit sắt (FeS2) có thể sản xuất được bao nhiêu tấn dung dịch H2SO4 50%, biết hiệu suất của quá trình sản xuất là 80%.
Đổi 1,2 tấn = 1200 kg
Ta có: \(n_{FeS_2}=\dfrac{1200}{120}=10\left(kmol\right)\)
Bảo toàn Lưu huỳnh: \(n_{H_2SO_4\left(lý.thuyết\right)}=2n_{FeS_2}=20\left(kmol\right)\)
\(\Rightarrow m_{ddH_2SO_4\left(thực\right)}=\dfrac{20\cdot98}{50\%}\cdot80\%=3136\left(kg\right)=3,136\left(tấn\right)\)
Đúng 0
Bình luận (1)
Trong công nghiệp người ta sản xuất axít sunfuric theo sơ đồ sau: FeS2
→
SO2
→
SO3
→
H2SO4 . Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axít sunfuric từ quặng trên là: A. 40% B. 60% C. 80% D. 62,5%
Đọc tiếp
Trong công nghiệp người ta sản xuất axít sunfuric theo sơ đồ sau: FeS2 → SO2 → SO3 → H2SO4 . Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axít sunfuric từ quặng trên là:
A. 40%
B. 60%
C. 80%
D. 62,5%
Trong công nghiệp người ta sản xuất axit sunfuric theo sơ đồ sau: FeS2 → SO2 → SO3 → H2SO4. Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axit sunfuric từ quặng trên là: A. 40%. B. 60%. C. 80%. D. 62,5%
Đọc tiếp
Trong công nghiệp người ta sản xuất axit sunfuric theo sơ đồ sau:
FeS2 → SO2 → SO3 → H2SO4.
Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axit sunfuric từ quặng trên là:
A. 40%.
B. 60%.
C. 80%.
D. 62,5%
Đáp án C.
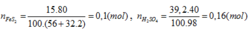
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%
Đúng 0
Bình luận (0)
Từ 80 tấn quặng FeS2 chứa 40% lưu huỳnh sản xuất được 92 tấn H2SO4
a) tính hiệu suất của quá trình
b) từ 92 tấn H2SO4 có thể pha chế thành bao nhiêu tấn dd H2SO4
giúp mình nha mấy chế
Từ 80 tấn quặng FeS2 chứa 40% lưu huỳnh sản xuất được 92 tấn H2SO4
a) tính hiệu suất của quá trình
b) từ 92 tấn H2SO4 có thể pha chế thành bao nhiêu tấn dd H2SO4
mình cần gấp gấp cực kì giúp mình
nha
Từ 80 tấn quặng pirit chứa 40% lưu huỳnh, người ta sản xuất được 73,5 tấn axit sunfuric. Tính hiệu suất của quá trình sản xuất axit sunfuric.
Khối lượng lưu huỳnh chứa trong 80 tấn quặng:
m S = 80x40/100 = 32 tấn
Điều chế H 2 SO 4 theo sơ đồ sau
S → SO 2 → SO 3 → H 2 SO 4
Ta thấy: Cứ 32g S thì sản xuất được 98g H 2 SO 4
⇒ m H 2 SO 4 = 32x98/32 = 98 tấn
Hiệu ứng phản ứng: H = 73,5/98 x 100 = 75%
Đúng 0
Bình luận (0)
Có một loại quặng pirit chứa 96% FeS2. Nếu mỗi ngày nhà máy sản xuất 100 tấn axit sunfuric 98% thì cần m tấn quặng pirit trên và biết hiệu suất của cả quá trình sản xuất H2SO4 là 90%. Gía trị của m là: A. 69,44 tấn B. 68,44tấn C. 67,44 tấn D. 70,44tấn
Đọc tiếp
Có một loại quặng pirit chứa 96% FeS2. Nếu mỗi ngày nhà máy sản xuất 100 tấn axit sunfuric 98% thì cần m tấn quặng pirit trên và biết hiệu suất của cả quá trình sản xuất H2SO4 là 90%. Gía trị của m là:
A. 69,44 tấn
B. 68,44tấn
C. 67,44 tấn
D. 70,44tấn
Từ 3 tấn quặng pirit sắt FeS2 (chứa 5% tạp chất) người ta điều chế được bao nhiêu tấn dung dịch H2SO4 98%. Biết hiệu suất của cả quá trình là 80%
ôi t làm nhầm....kq là
3,8 tấn ( cân bằng thêm 2 vào h2so4 là okok)
Đúng 0
Bình luận (2)
FeS2 ==> H2SO4
120g 98g
2,85( vì 5% tạp chất) 2,3275 (tấn)
vì H=80% ====> m H2SO4=1,3965( tấn). nhưng có C% H2SO4= 98%
VẬY mdd H2S04 là 1,425 tấn
Đúng 0
Bình luận (5)
Trong công nghiệp, axit sunfuric được điều chế từ quặng pirit sắt. Khối lượng dung dịch
H
2
S
O
4
98% điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80%
F
e
S
2
(hiệu suất toàn quá trình là 80%) là A. 0,80 tấn B. 1,60 tấn C. 1,25 tấn D. 2,00 tấn
Đọc tiếp
Trong công nghiệp, axit sunfuric được điều chế từ quặng pirit sắt. Khối lượng dung dịch H 2 S O 4 98% điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80% F e S 2 (hiệu suất toàn quá trình là 80%) là
A. 0,80 tấn
B. 1,60 tấn
C. 1,25 tấn
D. 2,00 tấn