Giúp mk với!
Trộn 200ml dung dịch NaCl 3M với 500ml dung dịch HCl 2M ( không xảy ra phản ứng Hóa Học ).
Xác định nồng độ M của dung dịch thu được
Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc, dư. Dẫn khí thoát ra đi vào 500ml dung dịch NaOH 4M (ở nhiệt độ thường).
a) Viết phương trình hóa học của phản ứng xảy ra.
b) Xác định nồng độ mol/l của những chất có trong dung dịch sau phản ứng. Biết rằng tinh thể của dung dịch sau phản ứng thay đổi không đáng kể
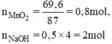
a) Phương trình hóa học của phản ứng:
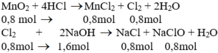
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 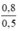 = 1,6 mol/ lit
= 1,6 mol/ lit
CM (NaOH)dư = 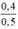 = 0,8 mol/ lit
= 0,8 mol/ lit
Bài 14.Trộn 300 gam dung dịch H2SO49,8% với 200 gam dung dịch BaCl226%, thu được a gam kết tủa và dung dịch X.
a) Viết phương trình hóa học của phản ứng xảy ra. Tính a.
b) Xác định nồng độ phần trăm các chất trong dung dịch X.
\(a,\left\{{}\begin{matrix}m_{H_2SO_4}=\dfrac{300\cdot9,8\%}{100\%}=29,4\left(g\right)\\m_{BaCl_2}=\dfrac{200\cdot26\%}{100\%}=52\left(g\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\\n_{BaCl_2}=\dfrac{52}{208}=0,25\left(mol\right)\end{matrix}\right.\\ PTHH:H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_4\downarrow\)
Vì \(\dfrac{n_{H_2SO_4}}{1}>\dfrac{n_{BaCl_2}}{1}\) nên sau phản ứng \(H_2SO_4\) dư
\(\Rightarrow n_{BaSO_4}=0,25\left(mol\right)\\ \Rightarrow a=m_{BaSO_4}=0,25\cdot233=58,25\left(g\right)\)
\(b,n_{HCl}=2n_{BaCl_2}=0,5\left(mol\right)\\ \Rightarrow m_{CT_{HCl}}=0,5\cdot36,5=18,25\left(g\right)\\ m_{dd_{HCl}}=300+200-58,25=441,75\left(g\right)\\ \Rightarrow C\%_{HCl}=\dfrac{18,25}{441,75}\cdot100\%\approx4,13\%\)
Cho mg muối CaCO3 phản ứng vừa đủ với 150g dung dịch HCL . Sau phản ứng thu được 6,72 lít khí CO2 (đktc) A) viết phương trình hóa học xảy ra B) xác định m C) viết nồng độ % của dung dịch axit đã dùng
a) \(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: CaCO3 + 2HCl ---> CaCl2 + CO2 + H2O
0,3<-----0,6<------------------0,3
=> m = 0,3.100 = 30 (g)
b) \(C\%_{HCl}=\dfrac{0,6.36,5}{150}.100\%=14,6\%\)
Trộn 300 gam dung dịch H2SO4 9,8% với 200 gam dung dịch BaCl2 26%, thu được a gam kết tủa và dung dịch X.
a) Viết phương trình hóa học của phản ứng xảy ra. Tính a.
b) Xác định nồng độ phần trăm các chất trong dung dịch X.
Giúp mh đi mn.
\(a,PTHH:H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\\ \left\{{}\begin{matrix}m_{H_2SO_4}=\dfrac{300\cdot9,8\%}{100\%}=29,4\left(g\right)\\m_{BaCl_2}=\dfrac{200\cdot26\%}{100\%}=52\left(g\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\\n_{BaCl_2}=\dfrac{52}{208}=0,25\left(mol\right)\end{matrix}\right.\)
Vì \(\dfrac{n_{H_2SO_4}}{1}>\dfrac{n_{BaCl_2}}{1}\) nên H2SO4 dư
\(\Rightarrow n_{BaSO_4}=n_{BaCl_2}=0,25\left(mol\right)\\ \Rightarrow a=m_{BaSO_4}=0,25\cdot233=58,25\left(g\right)\\ b,n_{HCl}=n_{BaCl_2}=0,25\left(mol\right)\\ \Rightarrow m_{CT_{HCl}}=0,25\cdot36,5=9,125\left(g\right)\\ m_{dd_{HCl}}=300+200-58,25=441,75\left(g\right)\\ \Rightarrow C\%_{HCl}=\dfrac{9,125}{441,75}\cdot100\%\approx2,07\%\)
Trộn 500ml dung dịch NaOH nồng độ xM với 500ml dung dịch H2SO4 nồng độ yM thu được dung dịch E. Dung dịch E có khả năng hòa tan hết 1,02g Al2O3. Mặt khác cho dung dịch E phản ứng với dung dịch BaCl2 dư thu được 23,3g kết tủa trắng. Xác định giá trị x,y
nH2SO4 = nBaSO4 = 0,1
-> y = 0,2 (mol/l)
nAl2O3 = 0,01
TH1: Axit dư:
H2SO4 + 2NaOH —> Na2SO4 + 2H2O
0,25x 0,5x
3H2SO4 + Al2O3 —> Al2(SO4)3 + 3H2O
0,03 0,01
-> nH2SO4 = 0,25x + 0,03 = 0,1
-> x = 0,28 (mol/l)
TH2: NaOH dư:
H2SO4 + 2NaOH —> Na2SO4 + 2H2O
0,1 0,2
Al2O3 + 2NaOH —> 2NaAlO2 + H2O
0,01 0,02
-> nNaOH tổng = 0,5x = 0,22
-> x = 0,44 (mol/l)
Vậy \(\left[{}\begin{matrix}x=0,28\\x=0,44\end{matrix}\right.\)(mol/l)
y = 0,2 (mol/l)
Trộn 300ml dung dịch HCl 0,05M với 200ml dung dịch Ba(OH)2 nồng độ a mol/l thu được 500ml dung dịch có pH = x. Cô cạn dung dịch sau phản ứng thu được 1,9875 gam chất rắn. Giá trị của a và x lần lượt là
![]()
![]()
![]()
![]()
Trộn 300ml dung dịch HCl 0,05M với 200ml dung dịch Ba(OH)2 nồng độ a mol/l thu được 500ml dung dịch có pH = x. Cô cạn dung dịch sau phản ứng thu được 1,9875 gam chất rắn. Giá trị của a và x lần lượt là
A. 2 , 5 . 10 - 3 M ; 13
B. 2 , 5 . 10 - 3 M ; 12
C. 0 , 05 M ; 13
D. 0 , 05 M ; 12
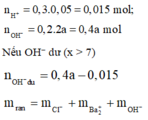
→ 0,015.35,5 + 0,2a.137 + 17(0,4a - 0,015) = 1,9875
→ a = 0,05 M

Đáp án D
Trộn 200ml dung dịch h2so4 1M với 500ml dung dịch h2so4 3M thì thu được dung dịch nồng độ bao nhiêu

Ta có: \(n_{H_2SO_4\left(1\right)}=0,2.1=0,2\left(mol\right)\)
\(n_{H_2SO_4\left(2\right)}=0,5.3=1,5\left(mol\right)\)
\(\Rightarrow\Sigma n_{H_2SO_4}=0,2+1,5=1,7\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{1,7}{0,2+0,5}\approx2,4M\)
Bạn tham khảo nhé!
cho 10g hỗn hợp 2 muối Na2CO3 và NaCl tác dụng vừa đủ với 200ml dung dịch HCL thu được 896ml ( đktc ) khí CO2
a.Viết Phương Trình Hóa Học Của phản ứng xảy ra
b. Tính nồng độ mol của dung dịch HCL đã dùng
c. Tính thành phần phần trăm về khối lượng của mỗi muối trong hỗn hợp ban đầu
a, \(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
b, \(n_{CO_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{CO_2}=0,08\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,08}{0,2}=0,4\left(M\right)\)
c, \(n_{Na_2CO_3}=0,04\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Na_2CO_3}=\dfrac{0,04.106}{10}.100\%=42,4\%\\\%m_{NaCl}=57,6\%\end{matrix}\right.\)