Bài 1: Dẫn 2,24 lít khí lưu huỳnh đioxit đi qua 300ml dung dịch Ca(OH)2 0,1 M . Tính khối lượng các chất thu được sau phản ứng

Những câu hỏi liên quan
Dẫn khí lưu huỳnh đioxit ( đktc) đi qua 700ml dung dịch Ca(OH)2 0,1M a) Viết PTHH b) Tính khối lượng các chất sau phản ứng
nCa(OH)2=0,1.0,1=0,07(mol)
a, SO2+Ca(OH)2=>CaSO3+H2O
ta có nCaSO3=nH2O=nCa(OH)2=0,07(mol)
mCaSO3=0,07.120=8,4(g)
mH2O=1,26(g)
Đúng 0
Bình luận (0)
Dẫn 1,12 lít khí lưu huỳnh đioxit (đktc) đi qua 700 ml dung dịch Ca OH 2 0,1M. Tính khối lượng các chất sau phản ứng.
Khối lượng các chất sau phản ứng :
Số mol các chất đã dùng :
n SO 2 = 1,12/22,4 = 0,05 mol; n Ca OH 2 = 0,1x700/1000 = 0,07 mol
Theo phương trình hoá học, lượng Ca OH 2 đã dùng dư. Do đó khối lượng các chất sau phản ứng được tính theo lượng SO 2
0,05 mol SO 2 tác dụng với 0,05 mol Ca OH 2 sinh ra 0,05 mol CaSO 3 và dư 0,07 - 0,05 = 0,02 (mol) Ca OH 2
Khối lượng các chất sau phản ứng là :
m CaSO 3 = 120 x 0,05 = 6 (gam)
m Ca OH 2 = 74 x 0,02 = 1,48 (gam)
Đúng 0
Bình luận (0)
nhờ các bạn giải hộ mình bài này vs được không ạ ( mình xin cảm ơn )Bài 1: dẫn 1,12lit khí lưu huỳnh đioxit (đktc) đi qua 700ml dd Ca(OH)2 0,1Ma, viết PTHH xảy rab, tính khối lượng các chất sau phản ứng Bài 2: khí lưu huỳnh dioxit tạo thành từ những cặp chất nào sau đây? Viết PTHH sảy raa, k2SO3 và H2SO4b, K2SO4 và HClc, Na2SO3 và NaOHd, Na2SO4 và CuCl2e, K2SO3 và KClBài 3: hãy nhận biết các chất trong những nhóm sau bằng phương pháp hóa học, viết PTHH xảy raa, hai chất rắn màu trắng là: CaO và...
Đọc tiếp
nhờ các bạn giải hộ mình bài này vs được không ạ ( mình xin cảm ơn )
Bài 1: dẫn 1,12lit khí lưu huỳnh đioxit (đktc) đi qua 700ml dd Ca(OH)2 0,1M
a, viết PTHH xảy ra
b, tính khối lượng các chất sau phản ứng
Bài 2: khí lưu huỳnh dioxit tạo thành từ những cặp chất nào sau đây? Viết PTHH sảy ra
a, k2SO3 và H2SO4
b, K2SO4 và HCl
c, Na2SO3 và NaOH
d, Na2SO4 và CuCl2
e, K2SO3 và KCl
Bài 3: hãy nhận biết các chất trong những nhóm sau bằng phương pháp hóa học, viết PTHH xảy ra
a, hai chất rắn màu trắng là: CaO và P2O5
b, hai khí không màu là: SO2 và O2
mong các bạn giúp mình ( mình đang cần rất gấp )
Bài 1:
Ta có: \(n_{SO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=0,7.0,1=0,07\left(mol\right)\)
\(\Rightarrow\dfrac{n_{SO_2}}{n_{Ca\left(OH\right)_2}}=0,714< 1\)
Vậy: Pư tạo muối CaSO3.
a, PT: \(SO_2+Ca\left(OH\right)_2\rightarrow CaSO_3+H_2O\)
b, Theo PT: \(n_{Ca\left(OH\right)_2\left(pư\right)}=n_{CaSO_3}=n_{SO_2}=0,05\left(mol\right)\)
\(\Rightarrow n_{Ca\left(OH\right)_2\left(dư\right)}=0,02\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CaSO_3}=0,05.120=6\left(g\right)\\m_{Ca\left(OH\right)_2\left(dư\right)}=0,02.74=1,48\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Bài 2:
Các cặp chất phản ứng tạo khí SO2 là a.
PTHH: H2SO4 + K2SO3 -> K2SO4 + H2O + SO2
Đúng 2
Bình luận (0)
Bài 1:
nCa(OH)2= 0,07(mol)
nSO2=0,05(mol)
Vì: nCa(OH)2/nSO2>1
=> Ca(OH)2 dư
a) PTHH: Ca(OH)2 + SO2 -> CaSO3 + H2O
b) => mCaSO3=120.0,05=6(g)
mCa(OH)2(dư)=(0,07-0,05).74=1.48(g)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Dẫn 1,12 lít khí lưu huỳnh đioxit ( đktc) đi qua 700ml dung dịch Ca(OH)2 0,1M
a) Viết PTHH
b) Tính khối lượng các chất sau phản ứng
a, SO2 + Ca(OH)2--> CaSO3 + H2O
b, Ta có nSO2=1,12/22,4=0,05 mol
nCa(OH)2=0,1.0,7=0,07 mol
Ta có tỉ lệ : nSO2/1< nCa(OH)2/1
=> Ca(OH)2 dư , CO2 hết
=> nCa(OH)2 PỨ= nCaSO3=nSO2=0,05 mol=nH2O
=> mCa(OH)2 dư=(0,07-0,05).74=1,48 g
mCaSO3=0,05.120=6 g
mH2O=0,05.18=0,9 g
Đúng 0
Bình luận (0)
nSO2=1,12:22,4=0,05mol
nCa(OH) 2=0,1.0,7=0,07mol
SO2+Ca(OH)2--->CaSO3+H2O
0,05mol 0,07mol
0,05mol -->0,05mol -->0,05mol -->0,05mol
mCaSO3=0,05.120=6g
mH2O=0,05.18=0,9g
Đúng 1
Bình luận (1)
ta có: nSO2= \(\dfrac{1,12}{22,4}\)= 0,05( mol)
nCa(OH)2= 0,1. 0,7= 0,07( mol)
có: \(\dfrac{nSO2}{nCa\left(OH\right)2}\)= \(\dfrac{0,05}{0,07}\)= 0,714\(\Rightarrow\) tạo muối trung hòa
PTPU
Ca(OH)2+ SO2\(\rightarrow\) CaSO3+ H2O
0,05..........0,05......0,05............... mol
nCa(OH)2 dư= 0,07- 0,05= 0,02( mol)
\(\Rightarrow\) mCa(OH)2= 0,02. 74= 1,48( g)
mCaSO3= 0,05. 120= 6( g)
Đúng 0
Bình luận (0)
Dẫn 2,24 lít khí lưu huỳnh đioxit (đktc) đi qua 700ml dd Ca(OH)2 0,15M . a) Viết PTHH b) Tính khối lượng các chất sau phản ứng
a)SO2 +Ca(OH)2---->CaSO3 +H2O
0,1---------0,1----------------0,1--0,1
b) n\(_{SO2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
n\(_{Ca\left(OH\right)2}=0,7.0,15=0,105\left(mol\right)\)
=> Ca(OH)2 dư
Thwo pthh
n\(_{NaOH}dư=0,105=0,1=0,05\left(mol\right)\)
m\(_{NaOH}dư=0,05.40=2\left(g\right)\)
m\(_{CaSO3}=0,1.120=12\left(g\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (2)
PTHH :2SO2+Ca(OH)2\(\rightarrow\)Ca(HSO)3
b,nSO2 = 0,1 mol
=> n Ca(OH)2 = 0,1(mol)
=> n NaOH = 0,05 (mol)
mNaOH = 0,05.40 = 2(g)
=> mCaSO3 = 12(g)
Đúng 0
Bình luận (0)
SO2 + Ca(OH)2 ---> CaSO3 + H2O
0,1 0,1 0,1
nSO2 = 0,1 mol
nCa(OH)2 = 0,15.0,7 = 0,105 mol
Ta có: 0,1/1 < 0,105/1 => nCa(OH)2 dư
mCa(OH)2 dư = (0,105-0,1) . 74 = 3,7 g
mCaSO3 = 0,1.120 = 12 g
Đúng 0
Bình luận (0)
Dẫn 1,12 l khí SO2 (đktc) đi qua 300ml dung dịch Ca(OH)2 có nồng độ 0,2 mol.
a) Viết phương trình phản ứng hóa học.
b) Tính khối lượng các chất sau phản ứng.
c) Tính nồng độ mol của sản phẩm sau phản ứng.
Số mol của khí lưu huỳnh đioxit
nSO2 = \(\dfrac{V_{SO2}}{22,4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
300ml = 0,3l
Số mol của dung dịch canxi hidroxit
CMCa(OH)2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=0,2.0,3=0,06\left(mol\right)\)
a) Pt : SO2 + Ca(OH)2 → CaSO3 + H2O\(|\)
1 1 1 1
0,05 0,06 0,05
b) Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,06}{1}\)
⇒ SO2 phản ứng hết , Ca(OH)2 dư
⇒ Tính toán dựa vào số mol SO2
Số mol của canxi sunfit
nCaSO3 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của canxi sunfit
mCaSO3 = nCaSO3 . MCaSO3
= 0,05 . 120
= 6 (g)
Số mol dư của dung dịch canxi hidroxit
ndư = nban đầu - nmol
= 0,06 - (0,05.1)
= 0,01 (mol)
Khối lượng của dung dịch canxi hidroxit
mdư = ndư . MCa(OH)2
= 0,01 . 74
= 0,74 (g)
c) Thể tích của dung dịch sau phản ứng
Vdung dịch sau phản ứng= 1,12 + 0,3
= 1,42 (l)
Nồng độ mol của canxi sunfit
CMCaSO3 = \(\dfrac{n}{V}=\dfrac{0,05}{1,42}=0,04\left(M\right)\)
Nồng độ mol của dung dịch cnaxi hidroxit
CMCa(OH)2 = \(\dfrac{n}{V}=\dfrac{0,01}{1,42}=0,007\left(M\right)\)
Chúc bạn học tốt
Đúng 4
Bình luận (1)
Dẫn 1,12 lít khí S
O
2
(đktc) đi qua 700 ml dung dịch Ca(
O
H
)
2
0,1M. Khối lượng của muối thu được sau phản ứng là A. 8 gam B. 12 gam C. 6 gam D. 9 gam
Đọc tiếp
Dẫn 1,12 lít khí S O 2 (đktc) đi qua 700 ml dung dịch Ca( O H ) 2 0,1M. Khối lượng của muối thu được sau phản ứng là
A. 8 gam
B. 12 gam
C. 6 gam
D. 9 gam
Chọn C

S O 2 hết, Ca( O H ) 2 dư, phản ứng tạo muối CaS O 3
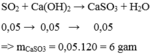
Đúng 0
Bình luận (0)
Dẫn từ từ 4.48 lít khí lưu huỳnh đioxit vào 0.12 mol dung dịch Ca(OH)2
a.Chất nào còn dư, dư bao nhiêu gam?
b.Tính khối lượng muối thu được.
SO2. +. Ca(OH)2 -------> 0,12. 0,12
CaSO3. +. H2O
0,12. 0,12
nSO2=4,48/22,4=0,2mol
Lập tỉ số
nso2/1nca:(oh)2/1=0,2>0,12
--->so2 dư và ca(oh)2 hết
nso2du=0,2-0,12=0,08mol
mso2du=0,08*64=5,12g
mcaso3=120*0,12=14,4g
Đúng 0
Bình luận (3)
Viết pt, chuyển đổi ra số mol rồi xét tỉ lệ số mol / hệ số.
Tỉ lệ của chất nào lớn hơn thì chất đó dư.
Hình như bạn viết thiếu phần M của dung dịch á.
Đúng 0
Bình luận (0)
Dẫn 1,12 lít khí lưu huỳnh dioxit ( đktc) vào 700ml dd Ca(OH)2 0,1M a. Cho biết muối nào tạo thành b. Tính khối lượng các chất sau phản ứng
Số mol của lưu huỳnh đioxit ở dktc
nSO2 = \(\dfrac{V_{SO2}}{22,4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
700ml = 0,7l
Số mol của dung dịch canxi hidroxi CMCa(OH)2 = \(\dfrac{n}{V}\Rightarrow n=C_m.V=0,1.0,7=0,07\left(mol\right)\)
Pt : SO2 + Ca(OH)2 → CaSO3 + H2O\(|\)
1 1 1 1
0,05 0,07 0,05
a) Tên muối tạo thành là : canxi sunfit
b) Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,07}{1}\)
⇒ SO2 phản ứng hết , Ca(OH)2 dư
⇒ Tính toán dựa vào số mol của SO2
Số mol của muối canxi sunfit
nCaSO3 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của muối canxi sunfit
mCaSO3 = nCaSO3 . MCaSO3
= 0,05 . 120
= 6 (g)
Số mol dư của dung dịch canxi hidroxit
ndư = nban đầu - nmol
= 0,07 - (0,05 . 1)
= 0,02 (mol)
Khối lượng dư của dung dịch canxi hidroxit
mdư = ndư . MCa(OH)2
= 0,02 . 74
= 1,48 (g)
Chúc bạn học tốt
Đúng 3
Bình luận (0)




























