Sủi 2,24 l SO3 vào 400g dung dịch NaOH 8% (D = 1,2 g/ml). Tính CM của dung dịch sau phản ứng

Những câu hỏi liên quan
Cho 2,24 lít khí CO2 (đktc) vào 50ml dung dịch NaOH 10% (D = 1,28g/ml). Tính nồng độ % của dung dịch sau phản ứng
\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(m_{dd.NaOH}=50.1,28=64\left(g\right)\)
=> \(n_{NaOH}=\dfrac{64.10\%}{40}=0,16\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,16}{0,1}=1,6\)
=> Tạo ra muối Na2CO3 và NaHCO3
PTHH: 2NaOH + CO2 --> Na2CO3 + H2O
0,16--->0,08---->0,08
Na2CO3 + CO2 + H2O --> 2NaHCO3
0,02<---0,02------------->0,04
=> \(\left\{{}\begin{matrix}m_{Na_2CO_3}=\left(0,08-0,02\right).106=6,36\left(g\right)\\m_{NaHCO_3}=0,04.84=3,36\left(g\right)\end{matrix}\right.\)
mdd sau pư = 0,1.44 + 64 = 68,4 (g)
\(\left\{{}\begin{matrix}C\%_{Na_2CO_3}=\dfrac{6,36}{68,4}.100\%=9,3\%\\C\%_{NaHCO_3}=\dfrac{3,36}{68,4}.100\%=4,9\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
cho 80ml dung dich NaOH 2M (D=1,2 g/ml) vào dung dịch FeCl2 10%
a/ tính mFeCl2 phản ứng
b/ tính C% chất tan sau phản ứng
Cho 400g dung dịch NaOH 30% tác dụng với 200ml dung dịch Hcl 20%( D=1,14g/ml).Tính C% các chất trong dung dịch sau phản ứng
\(n_{NaOH}=\dfrac{400.30\%}{40}=3\left(mol\right)\)
\(n_{HCl}=\dfrac{1,14.200.20\%}{36,5}=1,25\left(mol\right)\)
PTHH: NaOH + HCl ----------> NaCl +H2O
Theo đề : 3.........1,25
Lập tỉ lệ :\(\dfrac{3}{1}>\dfrac{1,25}{1}\)=> Sau phản ứng NaOH dư, HCl phản ứng hết
Vậy các dung dịch sau phản ứng là NaOH dư và NaCl
Ta có : \(n_{NaCl}=n_{HCl}=1,25\left(mol\right)\)
\(n_{NaOHdư}=3-1,25=1,75\left(mol\right)\)
\(m_{ddsaupu}=400+1,14.200=628\left(g\right)\)
\(C\%_{NaOHdư}=\dfrac{1,75.40}{628}.100=11,15\%\)
\(C\%_{NaCl}=\dfrac{1,25.58,5}{628}.100=11,64\%\)
Đúng 2
Bình luận (2)
Ta có: \(m_{NaOH}=400.30\%=120\left(g\right)\Rightarrow n_{NaOH}=\dfrac{120}{40}=3\left(mol\right)\)
m dd HCl = 200.1,14 = 228 (g)
\(\Rightarrow m_{HCl}=228.20\%=45,6\left(g\right)\Rightarrow n_{HCl}=\dfrac{45,6}{36,5}=\dfrac{456}{365}\left(mol\right)\)
PT: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Xét tỉ lệ: \(\dfrac{3}{1}>\dfrac{\dfrac{456}{365}}{1}\), ta được NaOH dư.
Theo PT: \(n_{NaOH\left(pư\right)}=n_{NaCl}=n_{HCl}=\dfrac{456}{365}\left(mol\right)\)
\(\Rightarrow n_{NaOH\left(dư\right)}=\dfrac{639}{365}\left(mol\right)\)
Ta có: m dd sau pư = 400 + 228 = 628 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{NaCl}=\dfrac{\dfrac{456}{365}.58,5}{628}.100\%\approx11,64\%\\C\%_{NaOH\left(dư\right)}=\dfrac{\dfrac{639}{365}.40}{628}.100\%\approx11,15\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Cho 2,24 lít khí CO2 ( đktc) vào 150ml dung dịch NaOH 1M. Tính CM chất có trong dung dịch sau phản ứng ?
Ta có: \(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Đổi 150ml = 0,15 lít
Ta lại có: \(n_{NaOH}=0,15.1=0,15\left(mol\right)\)
Ta có: \(T=\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,15}{0,1}=1,5\left(1< 1,5< 2\right)\)
Vậy, ta có PTHH:
CO2 + 2NaOH ---> Na2CO3 + H2O (1)
CO2 + NaOH ---> NaHCO3 (2)
Gọi x, y lần lượt là số mol của Na2CO3 và NaHCO3
Theo PT(1): \(n_{CO_2}=n_{Na_2CO_3}=x\left(mol\right)\)
Theo PT(1): \(n_{NaOH}=2.n_{Na_2CO_3}=2x\left(mol\right)\)
Theo PT(2): \(n_{CO_2}=n_{NaOH}=n_{NaHCO_3}=y\left(mol\right)\)
Vậy, ta có HPT:
\(\left\{{}\begin{matrix}x+y=0,1\\2x+y=0,15\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,05\end{matrix}\right.\)
=> \(n_{muối.sau.phản.ứng}=0,05+0,05=0,1\left(mol\right)\)
Ta có: \(V_{dd_{muối.sau.phản.ứng}}=V_{dd_{NaOH}}=0,15\left(lít\right)\)
=> \(C_{M_{sau.phản.ứng}}=\dfrac{0,1}{0,15}=\dfrac{2}{3}M\)
Đúng 0
Bình luận (1)
Cho 1,36 gam hỗn hợp A gồm Fe và Mg vào 400 ml dung dịch CuSO 4 . Sau phản ứng xongthu được 1,84 g chất rắn B và dung dịch C. Thêm NaOH dư vào C được kết tủa. Nung kết tủađến khối lượng không đổi ngoài không khí được 1,2 g chất rắn D.a. Tính % khối lượng mỗi kim loại trong A và nồng độ mol dung dịch CuSO 4 đã dùng?b. Cho 1,36 g hỗn hợp A tác dụng với V ml dung dịch AgNO 3 0,1M. Kết thúc phản ứng thuđược 3,36 g chất rắn E. Tính % các chất trong E và thể tích V dung dịch AgNO 3
Đọc tiếp
Cho 1,36 gam hỗn hợp A gồm Fe và Mg vào 400 ml dung dịch CuSO 4 . Sau phản ứng xong
thu được 1,84 g chất rắn B và dung dịch C. Thêm NaOH dư vào C được kết tủa. Nung kết tủa
đến khối lượng không đổi ngoài không khí được 1,2 g chất rắn D.
a. Tính % khối lượng mỗi kim loại trong A và nồng độ mol dung dịch CuSO 4 đã dùng?
b. Cho 1,36 g hỗn hợp A tác dụng với V ml dung dịch AgNO 3 0,1M. Kết thúc phản ứng thu
được 3,36 g chất rắn E. Tính % các chất trong E và thể tích V dung dịch AgNO 3
Cho 200 gam SO3 vào 1 lít dung dịch H2SO4 17% (D = 1,12 g/ml) được dung dịch A. Tính nồng độ phần trăm của dung dịch A
giải thích tại sao mdd tăng lại bằng mSO3 phản ứng? Tại sao?
PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{SO_3}=\dfrac{200}{80}=2,5\left(mol\right)=n_{H_2SO_4}\)
Mặt khác: \(m_{ddH_2SO_4}=1000\cdot1,12=1120\left(g\right)\) \(\Rightarrow m_{H_2SO_4\left(ban.đầu\right)}=1120\cdot17\%=190,4\left(g\right)\)
Bảo toàn khối lượng: \(m_{ddH_2SO_4\left(sau\right)}=m_{SO_3}+m_{ddH_2SO_4\left(ban.đầu\right)}=1320\left(g\right)\)
\(\Rightarrow C\%=\dfrac{2,5\cdot98+190,4}{1320}\cdot100\%\approx32,98\%\)
Đúng 4
Bình luận (0)
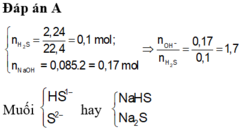
Cho 2,24 lit (đktc) khí H2S hấp thụ hết vào 85 ml dung dịch NaOH 2M, sau phản ứng thu được dung dịch X. Dung dịch X chứa các chất tan gồm: A. NaHS và Na2S B. NaHS C. Na2S D. Na2S và NaOH
Đọc tiếp
Cho 2,24 lit (đktc) khí H2S hấp thụ hết vào 85 ml dung dịch NaOH 2M, sau phản ứng thu được dung dịch X. Dung dịch X chứa các chất tan gồm:
A. NaHS và Na2S
B. NaHS
C. Na2S
D. Na2S và NaOH
14,6g dung dịch Zn , ZnO vào 400g dung dịch HCl thu được 2,24 lít khí
a) ?g
b) C% HCl phản ứng
c) C% dung dịch sau phản ứng
Cho 2,24 lít (đktc) SO2 hấp thụ hoàn toàn vào 200 ml dung dịch NaOH 1,5 M. Dung dịch thu được sau phản ứng chứa chất nào?
n SO2=0,1 mol, n NaOH=0,3 mol
=>\(\dfrac{nNaOH}{nSO2}\)=3
Tạo Na2SO3
SO2 + 2NaOH → Na2SO3 + H2O
=> thu đc Na2CO3, NaOH dư
Đúng 3
Bình luận (1)