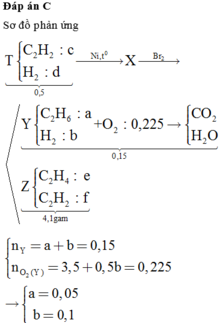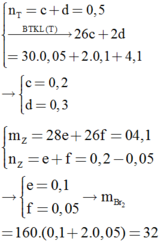dẫn 3,36 lít khí CO qua ống sứ nung nóng đựng 16 g CuO , SAU MỘT THỜI GIAN PHẢN ỨNG THU ĐƯỢC CHÁT RẮN b có khối lượng 14.4 g và V lít hỗn hợp chát khí

Những câu hỏi liên quan
Dẫn từ từ khí CO qua ống sứ nung nóng đựng 26,4 gam hỗn hợp các oxit kim loại. Sau phản ứng hoàn toàn, thu được 3,36 lít (đktc) một khí duy nhất. Khối lượng rắn còn lại sau phản ứng?
\(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Có nO(mất đi) = nCO2 = 0,15 (mol)
=> mrắn sau pư = 26,4 - 0,15.16 = 24(g)
Đúng 3
Bình luận (0)
Dẫn V lít khí CO (đktc) qua ống sứ nung nóng đựng CuO dư. Sau khi phản ứng hoàn toàn, chỉ thu được 1 khí duy nhất đồng thời khối lượng chất rắn giảm 3,2 gam. Giá trị của V là A. 3,36. B. 2,24 C. 4,48 D. 5,60
Đọc tiếp
Dẫn V lít khí CO (đktc) qua ống sứ nung nóng đựng CuO dư. Sau khi phản ứng hoàn toàn, chỉ thu được 1 khí duy nhất đồng thời khối lượng chất rắn giảm 3,2 gam. Giá trị của V là
A. 3,36.
B. 2,24
C. 4,48
D. 5,60
Chọn C
Bản chất của phản ứng là CO lấy O của CuO tạo Cu và CO2 Þ Phần khối lượng giảm chính là khối lượng của O bị lấy ra, lại có chỉ thu đc 1 khí (CO2) Þ CO không còn dư
Þ nCuO phản ứng = 3,2/16 = 0,2 = nCO Þ V = 0,2x22,4 = 4,48.
Đúng 0
Bình luận (0)
Cho từ từ V lít hỗn hợp khí CO, H2 đi qua ống sứ đựng 16,8 gam hỗn hợp 3 oxit CuO, Fe2O3, Al2O3. Sau phản ứng hoàn toàn thu được hỗn hợp khí và hơi nặng hơn hỗn hợp CO, H2 ban đầu 0,32g. Giá trị của V và khối lượng chất rắn còn lại trong ống sứ sau khi nung nóng lần lượt là A. 4,48 lít và 13,6g. B. 0,448 lít và 16,48g. C. 0,336 lít và 16,56g. D. 0,112 lít và 16g.
Đọc tiếp
Cho từ từ V lít hỗn hợp khí CO, H2 đi qua ống sứ đựng 16,8 gam hỗn hợp 3 oxit CuO, Fe2O3, Al2O3. Sau phản ứng hoàn toàn thu được hỗn hợp khí và hơi nặng hơn hỗn hợp CO, H2 ban đầu 0,32g. Giá trị của V và khối lượng chất rắn còn lại trong ống sứ sau khi nung nóng lần lượt là
A. 4,48 lít và 13,6g.
B. 0,448 lít và 16,48g.
C. 0,336 lít và 16,56g.
D. 0,112 lít và 16g.
Ta có thể tổng quát các phản ứng như sau:
![]()
Quan sát 2 phản ứng trên, ta nhận thấy: khối lượng hỗn hợp khí và hơi thu được sau phản ứng nặng hơn hỗn hợp CO, H2 ban đầu là do H2, CO đã "chiếm lấy" những nguyên tử O trong oxit.
Khi đó khối lượng hỗn hợp khí tăng lên chính là khối lượng mà chất rắn đã giảm đi sau phản ứng hay khối lượng này chính là khối lượng của những nguyên tử oxi trong oxit bị "chiếm mất".
Suy ra m c h ấ t r ắ n p h ả n ứ n g - m o x i b a n đ ầ u - 0 , 32 = 16 , 48 ( g a m )
Cũng quan sát các phản ứng hoặc sử dụng định luật BTNT đối với C, H, có:
![]()
Đáp án B.
Đúng 0
Bình luận (0)
Một bình kín chứ 0,5 mol hỗn hợp axetilen và hiđro. Cho vào bình một ít bột Ni rồi nung nóng, sau một thời gian thu được hỗn hợp khí X. Dẫn X qua một dung dịch nước brom dư, sau phản ứng khối lượng dung dịch tăng 4,1 gam và thoát ra 3,36 lít (đktc) hỗn hợp khí Y. Đốt chát hoàn toàn Y cần vừa đủ 5,04 lít O2 (đktc). Khối lượng brom đã phản ứng với X là A. 16 gam B. 24 gam C. 32 gam D. 40 gam
Đọc tiếp
Một bình kín chứ 0,5 mol hỗn hợp axetilen và hiđro. Cho vào bình một ít bột Ni rồi nung nóng, sau một thời gian thu được hỗn hợp khí X. Dẫn X qua một dung dịch nước brom dư, sau phản ứng khối lượng dung dịch tăng 4,1 gam và thoát ra 3,36 lít (đktc) hỗn hợp khí Y. Đốt chát hoàn toàn Y cần vừa đủ 5,04 lít O2 (đktc). Khối lượng brom đã phản ứng với X là
A. 16 gam
B. 24 gam
C. 32 gam
D. 40 gam
13. Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và H2 qua một ống sứ đựng hỗn hợp Al2O3, CuO, Fe3O4, Fe2O3 có khối lượng là 24 gam dư đang được đun nóng. Sau khi kết thúc phản ứng khối lượng chất rắn còn lại trong ống sứ là A. 22,4 g B. 11,2 g C. 20,8 g D.16,8 g14.X là một oxit sắt. Biết 1,6g X tác dụng vừa hết với 30ml dd HCl 2M. X là oxit nào của sắt? A. FeO B. Fe2O3 C. F...
Đọc tiếp
13. Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và H2 qua một ống sứ đựng hỗn hợp Al2O3, CuO, Fe3O4, Fe2O3 có khối lượng là 24 gam dư đang được đun nóng. Sau khi kết thúc phản ứng khối lượng chất rắn còn lại trong ống sứ là
A. 22,4 g B. 11,2 g C. 20,8 g D.16,8 g
14.X là một oxit sắt. Biết 1,6g X tác dụng vừa hết với 30ml dd HCl 2M. X là oxit nào của sắt?
A. FeO B. Fe2O3 C. Fe3O4 D. Không xác định được
Cho 11g hỗn hợp Al, Fe tác dụng với một lượng dư dung dịch axit Clohidric. Sau khi các phản ứng xảy ra hoàn toàn, thu được V lít H2 (đktc). Dẫn toàn bộ lượng khí H2 này đi chậm qua ống sứ đựng 32g CuO nung nóng. Sau một thời gian, thấy trong ống sứ còn lại 26,88g chất rắn và chỉ có 80% H2 đã phản ứng.a) Viết phương trình hóa học của các phản ứng xảy ra.b) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Đọc tiếp
Cho 11g hỗn hợp Al, Fe tác dụng với một lượng dư dung dịch axit Clohidric. Sau khi các phản ứng xảy ra hoàn toàn, thu được V lít H2 (đktc). Dẫn toàn bộ lượng khí H2 này đi chậm qua ống sứ đựng 32g CuO nung nóng. Sau một thời gian, thấy trong ống sứ còn lại 26,88g chất rắn và chỉ có 80% H2 đã phản ứng.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
a) PTHH : \(2Al+6HCl-->2AlCl_3+3H_2\) (1)
\(Fe+2HCl-->FeCl_2+H_2\) (2)
\(H_2+CuO-t^o->Cu+H_2O\) (3)
b) Ta có : \(m_{CR\left(giảm\right)}=m_{O\left(lay.di\right)}\)
=> \(m_{O\left(lay.di\right)}=32-26,88=5,12\left(g\right)\)
=> \(n_{O\left(lay.di\right)}=\frac{5,12}{16}=0,32\left(mol\right)\)
Theo pthh (3) : \(n_{H_2\left(pứ\right)}=n_{O\left(lay.di\right)}=0,32\left(mol\right)\)
=> \(tổng.n_{H_2}=\frac{0,32}{80}\cdot100=0,4\left(mol\right)\)
Đặt \(\hept{\begin{cases}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{cases}}\) => \(27a+56b=11\left(I\right)\)
Theo pthh (1) và (2) : \(n_{H_2\left(1\right)}=\frac{3}{2}n_{Al}=\frac{3}{2}a\left(mol\right)\)
\(n_{H_2\left(2\right)}=n_{Fe}=b\left(mol\right)\)
=> \(\frac{3}{2}a+b=0,4\left(II\right)\)
Từ (I) và (II) => \(\hept{\begin{cases}a=0,2\\b=0,1\end{cases}}\)
=> \(\hept{\begin{cases}m_{Al}=27\cdot0,2=5,4\left(g\right)\\m_{Fe}=56\cdot0,1=5,6\left(g\right)\end{cases}}\)
bài 1: Hỗn hợp X gồm: CuO, FeO, và Fe3O4. Dẫn V lít khí CO dư (đktc) đi qua ống đựng m gam hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm, thu được 54 gam chất rắn Y trong ống sứ và 11,2 lít hỗn hợp khí A (đktc) có tỉ khối hơi so với H2 là 20,4.a/Viết PTHH.b/ Tính khối lượng mỗi khí trong hỗn hợp A.c/ Tính V, m.bài 2: Đốt cháy hoàn toàn 44,8 gam hỗn hợp gồm FeS và FeS2 trong V lít không khí (đktc) vừa đủ (không khí có 20% thể tích là O2, 80% thể tích là N2), thu được m gam Fe2O3 và V’ lít hỗn...
Đọc tiếp
bài 1: Hỗn hợp X gồm: CuO, FeO, và Fe3O4. Dẫn V lít khí CO dư (đktc) đi qua ống đựng m gam hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm, thu được 54 gam chất rắn Y trong ống sứ và 11,2 lít hỗn hợp khí A (đktc) có tỉ khối hơi so với H2 là 20,4.
a/Viết PTHH.
b/ Tính khối lượng mỗi khí trong hỗn hợp A.
c/ Tính V, m.
bài 2: Đốt cháy hoàn toàn 44,8 gam hỗn hợp gồm FeS và FeS2 trong V lít không khí (đktc) vừa đủ (không khí có 20% thể tích là O2, 80% thể tích là N2), thu được m gam Fe2O3 và V’ lít hỗn hợp khí (đktc) gồm N2 và SO2, trong đó SO2 chiếm 14,89% về thể tích.
a/ Viết PTHH.
b/ Tìm V.
c/ Tính khối lượng từng chất trong hỗn hợp đầu.
d/ Tìm m.
bài 3: Cacnalit là một loại muối có công thức là KCl.MgCl2.xH2O. Nung 33,3 gam muối đó tới khối lượng không đổi thì thu được 20,34 g muối khan.
a/ Tìm x.
b/ Tính số nguyên tử clo có trong 33,3 gam cacnalit.
Dẫn V lít khí CO (đktc) qua ống sứ nung nóng đựng lượng dư CuO. Sau khi phản ứng hoàn toàn, khối lượng chất rắn giảm 3,2 gam. Giá trị của V là A. 2,24. B. 3,36. C. 4,48 D. 5,60
Đọc tiếp
Dẫn V lít khí CO (đktc) qua ống sứ nung nóng đựng lượng dư CuO. Sau khi phản ứng hoàn toàn, khối lượng chất rắn giảm 3,2 gam. Giá trị của V là
A. 2,24.
B. 3,36.
C. 4,48
D. 5,60
Chọn C
nCO = nO trong oxit đã phản ứng = 3,2/16 = 0,2 ⇒ V = 4,48
Đúng 0
Bình luận (0)
Dẫn V lít khí CO (đktc) qua ống sứ nung nóng đựng lượng dư CuO. Sau khi phản ứng hoàn toàn, khối lượng chất rắn giảm 3,2 gam. Giá trị của V là
A. 2,24.
B. 3,36.
C. 4,48.
D. 5,60.
Đáp án : C
mrắn giảm = mO pứ = 3,2g => nO pứ = nCO = 0,2 mol
=> V = 4,48 lit
Đúng 0
Bình luận (0)