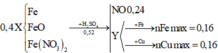
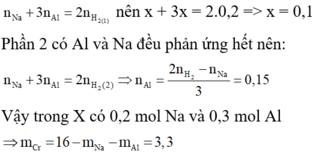Hoà tan hoàn toàn 11 gam hỗn hợp X gồm Al và Fe bằng dung dịch axit sunfuric loãng dư. Sau khi phản ứng phản ứng kết thúc thu được 8,96 lít khí (đktc).
a) Tính thành phần phần trăm về khối lượng mỗi kim loại trong hỗn hợp X.
b) Tính khối lượng muối khan thu được.
c) Lượng khí hiđro ở trên khử vừa đủ 23,2 gam oxit của kim loại M. Xác định CTHH của oxit đó.