Nung một hỗn hợp gồm MgCO3 , CaCO3 sau phản ứng thu được 4,4 gam chất khí các bon đi oxit Tính khối lượng khí này nếu hiệu suất đạt 90%
giúp mk vs
Nung 43,3 gam hỗn hợp gồm KMnO4 và KClO3. Sau một thời gian thu được khí X và chất rắn Y. Nguyên tố Mn chiếm 24,103% khối lượng chất rắn Y. Tính khối lượng của KMnO4 và KClO3 trong hỗn hợp ban đầu. Biết hiệu suất các phản ứng đều đạt 90%.
Gọi n KMnO4 = a
n KClO3 = b ( mol )
--> 158a + 122,5 b = 43,3
PTHH :
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
0,9b 1,35b
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
0,9a 0,45a
\(\%Mn=\dfrac{55a}{43,3-32\left(0,45a+1,35b\right)}=24,103\%\)
\(\rightarrow a=0,15\)
\(b=0,16\)
\(m_{KMnO_4}=0,15.158=23,7\left(g\right)\)
\(m_{KClO_3}=0,16.122,5=19,6\left(g\right)\)
Nung hỗn hợp X gồm C a C O 3 và M g C O 3 theo phản ứng :
C a C O 3 → t ° C a O + C O 2
M g C O 3 → t ° M g O + C O 2
Nếu đem nung 31,8 gam hỗn hợp X thì thu được 7,84 lít C O 2 (đktc). Tính khối lượng của hỗn hợp của oxit thu được.
Cho một luồng khí H2 đi qua ống sứa chứa 15,3g hỗn hợp FeO và ZnO nung nóng thu được một hỗn hợp chất rắn có khối lượng 12,74g. Biết rằng hiệu suất phản ứng đạt 80%. Tính phần trăm khối lượng mõi oxit trong hỗn hợp ban đầu
Đặt :
nFeO (bđ) = a (mol)
nZnO ( bđ) = b (mol)
=> mhh = 72a + 81b = 15.3 (g) (1)
FeO + H2 -to-> Fe + H2O
ZnO + H2 -to-> Zn + H2O
m chất rắn = mFeO dư + mZnO dư + mFe + mZn
=> 0.2a*72 + 0.2b*81 + 56*0.8a + 65*0.8b = 12.74
=> 59.2a + 68.2b = 12.74 (2)
(1) , (2) :
a = b = 0.1
%FeO = 0.1*72/15.3 * 100% = 47.06%
%ZnO = 100 - 47.06 = 52.94%
Hỗn hợp X gồm MgCO3 và CaCO3. Nung m gam hỗn hợp X ở nhiệt độ cao, thu được chất rắn Y và khí CO2. Cho Y vào nước, thu được chất rắn Z và dung dịch E. Hấp thụ hết lượng khí CO2 trên vào dung dịch E thu được 0,4 m gam chất rắn. Các phản ứng xảy ra hoàn toàn. Thành phần % theo khối lượng của CaCO3 trong hỗn hợp gần nhất với giá trị nào sau đây?
A. 60,0%
B. 64,8%
C. 40%
D. 72,6%
Câu 7:
1. Khử 34,8g Fe3O4 bằng khí H2 dư. Tính khối lượng chất rắn thu được sau phản ứng biết hiệu suất của phản ứng đạt 90%.
2. Nung 20g hỗn hợp Al, Mg, Zn trong không khí dư. Sau khi phản ứng kết thúc thu được 29,6g hỗn hợp chất rắn A. Cho A tác dụng với lượng dư H2SO4.
a. Viết PTHH xảy ra
b. Tính khối lượng muối sunfat thu được sau phản ứng
c. Nếu cho toàn bộ kim loại trên tác dụng với dung dịch HCl dư hãy tính thể tích khí H2 thu được ở đktc
\(n_{Fe_3O_4}=\dfrac{34,8}{232}=0,15\left(mol\right)\)
\(pthh:Fe_3O_4+H_2\underrightarrow{t^o}Fe+H_2O\)
0,15 0,15
=> \(m_{Fe}=\dfrac{90.0,15}{100}.56=7,56\left(g\right)\)
Câu 7 :
1) \(n_{Fe3O4}=\dfrac{34,8}{232}=0,15\left(mol\right)\)
Pt : \(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O|\)
1 4 3 4
0,15 0,45
\(n_{Fe}=\dfrac{0,15.3}{1}=0,45\left(mol\right)\)
\(m_{Fe\left(Lt\right)}=0,45.56=25,2\left(g\right)\)
⇒ \(m_{Fe\left(tt\right)}=25,2.90\%=22,68\left(g\right)\)
Chúc bạn học tốt
Cho 1 luồng khí CO dư đi qua ống sứ chứa 24 g hỗn hợp gồm Fe2O3 và CuO nung nóng thu được hỗn hợp chất rắn Y có khối lượng 18,88 gam.Biết trong điều kiện thí nghiệm hiệu suất các phản ứng đều đạt 80%.Tính % về khối lượng của mỗi oxit trong hỗn hợp ban đầu .
Đáp án:
→%mFe2O3=66,67%;%mCuO=33,33%→%mFe2O3=66,67%;%mCuO=33,33%
Giải thích các bước giải:
Gọi số mol 2 oxit lần lượt là x, y.
→160x+80y=24 gam→160x+80y=24 gam
Phản ứng xảy ra:
Fe2O3+3CO→2Fe+3CO2Fe2O3+3CO→2Fe+3CO2
CuO+COto→Cu+CO2CuO+CO→toCu+CO2
Khối lượng rắn giảm là do O bị khử
→nO bị khử=3nFe2O3 phản ứng+nCuO phản ứng=3x.80%+y.80%=24−18,8816=0,32 mol→nO bị khử=3nFe2O3 phản ứng+nCuO phản ứng=3x.80%+y.80%=24−18,8816=0,32 mol
Giải được: x=y=0,1.
→%mFe2O3=160x24=66,67%→%mCuO=33,33%
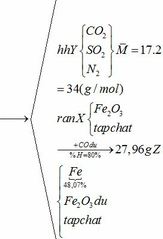
Hỗn hợp chất rắn A gồm FeCO3, FeS2 và tạp chất trơ. Hỗn hợp khí B gồm 20% oxi và 80% nitơ về thể tích. Cho hỗn hợp A vào bình kín dung tích 10 lít ( không đổi) chứa lượng hỗn hợp B vừa đủ. Nung nóng bình cho các phản ứng xảy ra hoàn toàn, các phản ứng cùng tạo ra một oxit sắt, oxit này phản ứng với dung dịch HNO3 dư không tạo ra khí. Sau phản ứng, đưa nhiệt độ bình về 136,50C, trong bình còn lại chất rắn X và hỗn hợp khí Y. Tỉ khối của Y so với H2 bằng 17 và áp suất trong bình là P atm. Cho dòng khí CO dư đi qua X đun nóng, biết rằng chỉ xảy ra phản ứng khử oxit sắt thành kim loại và đạt hiệu suất 80%.Sau phản ứng thu được 27,96 gam chất rắn Z, trong đó kim loại chiếm 48,07% khối lượng.
(a) Tính giá trị của P ( coi thể tích chất rắn X là rất nhỏ) và thành phần % khối lượng tạp chất trong A.
(b) Cho Y phản ứng với oxi ( dư) có V2O5 ( xúc tác) ở 4500C, hấp thụ sản phẩm vào 592,8 gam nước, được dung dịch C ( D = 1,02 gam/ml). Tính nồng độ mol của dung dịch C. Giả thiết hiệu suất của quá trình là 100%.
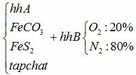
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
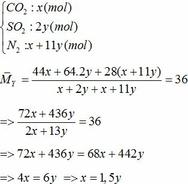
Khối lượng Fe có trong Z là:
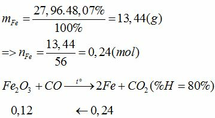
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
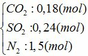
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
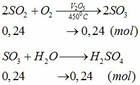
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
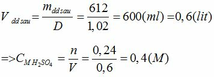
Thực hiện phản ứng nhiệt nhôm (trong điều kiện không có không khí, hiệu suất 100%) với 9,66 gam hỗn hợp X gồm Al và một oxit sắt, thu được hỗn hợp rắn Y. Hòa tan Y bằng dung dịch NaOH dư, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Z, chất không tan T và 0,03 mol khí. Sục khí CO2 dư vào dung dịch Z, lọc lấy kết tủa nung đến khối lượng không đổi thu được 5,1 gam một chất rắn. Công thức oxit sắt và khối lượng của nó trong hỗn hợp X là
A. Fe3O4 và 2,76 gam
B. Fe3O4 và 6,96 gam
C. FeO và 7,20 gam
D. Fe2O3 và 8,00 gam
1/Nung nóng 1,521g hỗn hợp gồm hai oxit CuO, FeO. Dẫn 0,784 lít khí H2 ở (đktc) đi qua hỗn hợp. Cho biết, kết thúc phản ứng, chất nào tham gia phản ứng hết, chất nào còn dư. Biết hiệu suất phản ứng đạt 100%.
2/ Một loại đá vôi chứa 80% CaCO3 về khối lượng, phần còn lại là chất trơ. Nung 500g đá vôi một thời gian thu được chất rắn có khối lượng bằng 78% khối lượng đá vôi trước khi nung. Tìm hiệu suất của phản ứng .(Biết chất trơ không tham gia phản ứng)
1/ Cách làm mang tính chất tham khảo:
\(n_{H_2}=\dfrac{0,784}{22,4}=0,035\left(mol\right)\)
Các PTHH hoá học xảy ra:
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\left(1\right)\\ FeO+H_2\underrightarrow{t^o}Fe+H_2O\left(2\right)\)
Giả sử trong hỗn hợp chỉ có: FeO \(\Rightarrow n_{FeO}=\dfrac{1,521}{72}=0,021125\left(mol\right)\)
\(\left(2\right)\Rightarrow n_{FeO}< n_{H_2}\left(0,021125< 0,035\right)\Rightarrow H_2dư\)
*Nói thêm về cách giải của mình:
Đây là "phương pháp bỏ bớt chất (giả thiết)" khá phổ biến, tuy nhiên nó chỉ có thể đúng khi áp dụng cho các cation hoặc gốc axit có cùng hoá trị. Ở đây nhận thấy được FeO, CuO có tính chất bị H2 khử giống hệt nhau (Chỉ khác mỗi phân tử khối) nên có thể áp dụng phương pháp này. Cơ sở của phương pháp như sau:
\(M_{FeO}< M< M_{CuO}\Rightarrow\dfrac{m}{M_{CuO}}< \dfrac{m}{M}< \dfrac{m}{M_{FeO}}\Rightarrow n_{CuO\left(gt\right)}< n_{hh}< n_{FeO\left(gt\right)}\)
Ở trên mình tính được: \(n_{FeO\left(gt\right)}< n_{H_2}\) cũng có nghĩa \(n_{hh}< n_{H_2}\Rightarrow H_2dư\)
2/ \(m_{CaCO_3trong500g}=80\%.500=400\left(g\right)\Rightarrow n_{CaCO_3}=\dfrac{400}{100}=4\left(mol\right)\)
Vì phản ứng một thời gian (phản ứng không hoàn toàn) sau khi kết thúc phản ứng còn CaCO3 dư. Vì vậy chất rắn thu được gồm CaO và CaCO3 dư.
PTHH xảy ra: \(CaCO_3\underrightarrow{t^o}CaO+CO_2\uparrow\)
Đặt số mol CaCO3 phản ứng là: x (mol) \(\Rightarrow n_{CaCO_3\left(dư\right)}=4-x\left(mol\right);n_{CaO}=x\left(mol\right)\)
Ta có phương trình: \(100.\left(4-x\right)+56x=78\%.400\Rightarrow x=2\left(mol\right)\)
Hiệu suất phản ứng: \(H\%=\dfrac{100.2}{400}.100=50\left(\%\right)\)