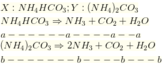Phân hủy hỗn hợp muối CaCO3 ; MgCO3 thu 76 gam hai oxit và 33,6 lít CO2 . Tính khối lượng hóa hợp ban đầu .

Những câu hỏi liên quan
Khi phân hủy bằng nhiệt 14,2 gam hỗn hợp CaCO3 và MgCO3 ta thu được 6,6 gam CO2 ( ở đktc). Tính thành phần phần trăm các chất trong hỗn hợp.
khi phân hủy bằng nhiệt 14,2 gam hỗn hợp X gồm CaCO3 và MgCO3 ta thu được chất rắn Y gồm CaO và MgO và 6,6 gam CO2. Tính thành phần % khối lượng các chất trong hỗn hợp X.
Gọi số mol CaCO3, MgCO3 là a, b (mol)
=> 100a + 84b = 14,2 (1)
\(n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
PTHH: CaCO3 --to--> CaO + CO2
a-------------------->a
MgCO3 --to--> MgO + CO2
b---------------------->b
=> a + b = 0,15
=> a = 0,1; b = 0,05
=> \(\left\{{}\begin{matrix}\%m_{CaCO_3}=\dfrac{100.0,1}{14,2}.100\%=70,42\%\\\%m_{MgCO_3}=\dfrac{0,05.84}{14,2}.100\%=29,58\%\end{matrix}\right.\)
Đúng 4
Bình luận (0)
\(n_{CO_2}=\dfrac{6,6}{44}=0,15mol\)
\(CaCO_3\underrightarrow{t^o}CO_2+CaO\)
\(x\) \(\rightarrow\) \(x\)
\(MgCO_3\underrightarrow{t^o}MgO+CO_2\)
\(y\) \(\rightarrow\) \(y\)
\(\Rightarrow\left\{{}\begin{matrix}100x+84y=14,2\\x+y=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\%m_{CaCO_3}=\dfrac{0,1\cdot100}{14,2}\cdot100\%=70,42\%\)
\(\%m_{MgCO_3}=100\%-70,42\%=29,57\%\)
Đúng 4
Bình luận (0)
Cho khí CO2 vào dung dịch NH3 được hỗn hợp hai muối X và Y (MX MY). Đun nóng hỗn hợp X, Y để phân hủy hết muối, thu được hỗn hợp khí và hơi, trong đó CO2 chiếm 30% thể tích. Tỉ lệ số mol hai muối nX : nY trong hỗn hợp là A. 1:2 B. 2:1 C. 2:3 D. 3:2
Đọc tiếp
Cho khí CO2 vào dung dịch NH3 được hỗn hợp hai muối X và Y (MX < MY). Đun nóng hỗn hợp X, Y để phân hủy hết muối, thu được hỗn hợp khí và hơi, trong đó CO2 chiếm 30% thể tích. Tỉ lệ số mol hai muối nX : nY trong hỗn hợp là
A. 1:2
B. 2:1
C. 2:3
D. 3:2
Những muối nào dưới đây bị phân hủy bởi nhiệt?
a. CaCO3, Na2SO4
b. MgCO3, KClO3
c. NaCl, AgNO3
d. KCl, KMnO4
Chọn B.
MgCO3 -to-> MgO + CO2
2 KClO3 -to-> 2 KCl + 3 O2
Đúng 3
Bình luận (0)
Cho khí CO2 tác dụng với dung dịch NH3 thu được hỗn hợp 2 muối (NH4)2CO3 (X) và NH4HCO3 (Y). Đun nóng hỗn hợp X, Y để phân hủy hết muối thu được hỗn hợp khí và hơi nước trong đó CO2 chiếm 30% thể tích. Tỉ lệ mol X và Y trong hỗn hợp là: A. 1 : 1 B. 1 : 2 C. 1 : 3 D. 1 : 4
Đọc tiếp
Cho khí CO2 tác dụng với dung dịch NH3 thu được hỗn hợp 2 muối (NH4)2CO3 (X) và NH4HCO3 (Y). Đun nóng hỗn hợp X, Y để phân hủy hết muối thu được hỗn hợp khí và hơi nước trong đó CO2 chiếm 30% thể tích. Tỉ lệ mol X và Y trong hỗn hợp là:
A. 1 : 1
B. 1 : 2
C. 1 : 3
D. 1 : 4
Đun nóng 127 gam hỗn hợp hai muối (NH4)2CO3 và NH4HCO3 hỗn hợp phân hủy hết thành khí và hơi nước. Làm nguội sản phẩm đến 270C thu được 86,1 lít hỗn hợp khí, dưới áp suất 1atm (nước bị ngưng tự có thể tích không đáng kể). Tỉ lệ số mol hai muối (NH4)2CO3 và NH4HCO3 trong hỗn hợp A. 1:2 B. 1:3 C. 2:3 D. 2:1
Đọc tiếp
Đun nóng 127 gam hỗn hợp hai muối (NH4)2CO3 và NH4HCO3 hỗn hợp phân hủy hết thành khí và hơi nước. Làm nguội sản phẩm đến 270C thu được 86,1 lít hỗn hợp khí, dưới áp suất 1atm (nước bị ngưng tự có thể tích không đáng kể). Tỉ lệ số mol hai muối (NH4)2CO3 và NH4HCO3 trong hỗn hợp
A. 1:2
B. 1:3
C. 2:3
D. 2:1
Lấy 5 gam hỗn hợp hai muối CaCO3 và CaSO4 cho tác dụng vừa đủ với dung dịch HCl tạo thành 448 ml khí (đktc). a.Viết phương trình phản ứng b. Tính khối lượng CaCO3 trong hỗn hợp c.Tính thành phần phần trăm theo khối lượng của mỗi muối trong hỗn hợp ban đầu.
\(n_{CO_2}=\dfrac{0,448}{22,4}=0,02(mol)\\ a,CaCO_3+2HCl\to CaCl_2+H_2O+CO_2\uparrow\\ b,n_{CaCO_3}=n_{CO_2}=0,02(mol)\\ \Rightarrow m_{CaCO_3}=0,02.100=2(g)\\ c,\%_{CaCO_3}=\dfrac{2}{5}.100\%=40\%\\ \%_{CaSO_4}=100\%-40\%=60\%\)
Đúng 1
Bình luận (0)
Khi phân hủy bằng nhiệt 14,2g CaCO3 và MgCO3 ta thu được 3,36 lít CO2 ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu là:
A. 29,58% và 70,42%.
B. 70,42% và 29,58%.
C. 65% và 35%.
D. 35% và 65%
\(n_{CaCO_3}=a\left(mol\right),n_{MgCO_3}=b\left(mol\right)\)
\(m=100a+84b=14.2\left(g\right)\left(1\right)\)
\(n_{CO_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(CaCO_3\underrightarrow{^{^{t^0}}}CaO+CO_2\)
\(MgCO_3\underrightarrow{^{^{t^0}}}MgO+CO_2\)
\(\Rightarrow a+b=0.15\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.05\)
\(\%CaCO_3=\dfrac{0.1\cdot100}{14.2}\cdot100\%=70.42\%\)
\(\%MgCO_3=29.58\%\)
Đúng 2
Bình luận (0)
Gọi số mol của \(CaCO_3\) và \(MgCO_3\) lần lượt là x và y => \(^m\)hỗn hợp = PT (1)
Phương trình hóa học:
\(CaCO_3\)→→ \(CaO+CO_2\)
x mol → x mol
\(MgCO_3\) →→ \(MgO+CO_2\)
y mol → y mol
=>\(n_{CO_2}\)=PT (2)
Đáp án là B
Đúng 1
Bình luận (1)
Chia 1 lượng hỗn hợp gồm MgCO3 và CaCO3 thành 2 phần bằng nhau.
Phần 1 nhiệt phân hoàn toàn thu được 3.36 l khí CO2 đktc
Phần 2 hòa tan hết trong dd HCl, sau đó cô cạn dd thu được 15.85g hỗn hợp muối khan.
Tính % về khối lượng của các muối trong hỗn hợp ban đầu
MgCO3 ----> MgO + CO2
CaCO3 -----> CaO + CO2
0,15 (mol) <------------ 0,15 (mol) (1) đây ý nói là tổng lượng mol CO2 = tổng lượng hỗn hợp muối
MgCO3 + HCl -------> MgCl2 + CO2 + H20
CaCO3 + HCl --------> CaCl2 + CO2 + H20
=> n(MgCO3,CaCO3) = n(MgCl2,CaCl2) = 0,15 (mol)
=> M(MgCl2,CaCl2) = 317/3
Sau đó, ta đặt: C (là phần trăm của CaCl2 trong hỗn hợp muối)
1-C (là phần trăm của MgCl2 trong hỗn hợp muối)
Với C là 100% trong hỗn hợp đó
=> 111C + 95x(1-C) = 317/3
Từ đó suy ra: C= 2/3
Vì lượng muối trong hỗn hợp tác dụng với HCl bằng lượng từng muối trong hỗn hợp ban đầu nên
%CaCO3 = 2/3x100% = 66,667%
%MgCO3 = 1/3x100% = 33,33%
Đúng 0
Bình luận (0)
Nung hỗn hợp 2 muối CaCO3 và MgCO3 thu được 76 gam hai oxit và 33,6 lít CO2 (đkc). Khối lượng hỗn hợp muối ban đầu là: A. 142 g B. 141 g C. 140 g D. 124 g
Đọc tiếp
Nung hỗn hợp 2 muối CaCO3 và MgCO3 thu được 76 gam hai oxit và 33,6 lít CO2 (đkc). Khối lượng hỗn hợp muối ban đầu là:
A. 142 g
B. 141 g
C. 140 g
D. 124 g