viết 4 phương tình khác nhau để điều chế oxi

Những câu hỏi liên quan
cho 5 chất cao,p2o5,mgo,caco3,nacl.nêu 10 phương pháp khác để nhau điều chế muối khác nhau để diều chế muối mỗi phương pháp viết 2 phương trình
giup mik vơi mình dang cần gấp
Cho hình vẽ sau: a. Nếu khí Y là khí oxi thì hình nào trên đây mô tả đúng sự điều chế oxi trong phòng thí nghiệm? Giải thích sự lựa chọn này. b. Viết hai phương trình hóa học điều chế khí oxi trong phòng thí nghiệm từ hai chất rắn X khác nhau.
Đọc tiếp
Cho hình vẽ sau:
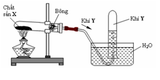
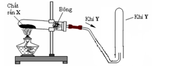
a. Nếu khí Y là khí oxi thì hình nào trên đây mô tả đúng sự điều chế oxi trong phòng thí nghiệm? Giải thích sự lựa chọn này.
b. Viết hai phương trình hóa học điều chế khí oxi trong phòng thí nghiệm từ hai chất rắn X khác nhau.
a. Khí O2 ít tan trong nước và nặng hơn không khí nên cách 1b không được (khi đó không khí sẽ xua hết khí O2 ra ngoài), trong phòng thí nghiệm người ta sử dụng cách 1a
b. Điều chế khí O2 người ta nhiệt phân các hợp chất giàu oxi: KMnO4; KClO3
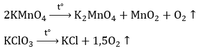
Đúng 0
Bình luận (0)
Viết ba phương trình hoá học khác nhau để điều chế CuCl2.
\(\left(1\right)CuO+2HCl\rightarrow CuCl_2+H_2O\\ \left(2\right)Cu\left(OH\right)_2+2HCl\rightarrow CuCl_2+H_2O\\ \left(3\right)CuSO_4+BaCl_2\rightarrow BaSO_4\downarrow\left(trắng\right)+CuCl_2\)
Đúng 0
Bình luận (0)
để điều chế oxi trong phòng thí nghiệm ta thường dùng KCLO3, KMNO4, viết phương trình phản ứng để điều chế oxi từ 2 chất trên?
2KClO3 \(\underrightarrow{t^o}\) 2KCl + 3O2\(\uparrow\)
2KMnO4 \(\underrightarrow{t^o}\) K2MnO4 + MnO2 + O2\(\uparrow\)
Đúng 0
Bình luận (0)
KClO3 => (to) KCl + 3/2 O2
2KMnO4 => (to) K2MnO4 + MnO2 + O2
Một số phương trình điều chế O2:
2H2O => 2H2 + O2
H2O2 => H2O + 1/2O2
O3 + 2Ag => Ag2O + O2
2NaOH => (đpnc kiềm) Na + H2O + 1/2 O2
F2 + H2O => 2HF + 1/2 O2
Đúng 0
Bình luận (0)
\(2KCLO_3\xrightarrow[t^o]{MnO_2}2KCL+3O_2\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm có thể dùng những muối KClO3 hoặc KNO3 để điều chế khí oxi bằng phản ứng phân hủy.a) Viết các phương trình hóa học đối xới mỗi chất.b) Nếu dùng 0,1 mol mỗi chất thì thể tích khí oxi thu được có khác nhau hay không? Hãy tính thể tích khí oxi thu được.c) Cần điều chế 1,12 lít khí oxi, hãy tính khối lượng mỗi chất cần dùng.Các thể tích khí được đo ở điều kiện tiêu chuẩn.
Đọc tiếp
Trong phòng thí nghiệm có thể dùng những muối KClO3 hoặc KNO3 để điều chế khí oxi bằng phản ứng phân hủy.
a) Viết các phương trình hóa học đối xới mỗi chất.
b) Nếu dùng 0,1 mol mỗi chất thì thể tích khí oxi thu được có khác nhau hay không? Hãy tính thể tích khí oxi thu được.
c) Cần điều chế 1,12 lít khí oxi, hãy tính khối lượng mỗi chất cần dùng.
Các thể tích khí được đo ở điều kiện tiêu chuẩn.
a) Các phương trình phản ứng
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
Theo (1): nO2 = nKNO3 =
= 0,05 mol; VO2 = 0,05x22,4 = 1,12 lít
Theo (2): nO2 = nKClO3 =
= 0,15 mol; VO2 = 0,15x22,4 = 3,36 lít
c) Để thu được 1,12 lít khí (0,05 mol) O2, thì:
Theo (1): nKNO3 = 2nO2 = = 0,1 mol; mKNO3 = 0,1x101 = 10,1 g
Theo (2): nKClO3 = nO2 =
x0,05 mol; VKClO3 =
x0,05x122,5 = 4,086 g.
Đúng 0
Bình luận (3)
a)
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b)
Từ pt(1)=> nO2 = \(\frac{1}{2}\)nKNO3 = \(\frac{0,1}{2}\) = 0,05 mol
VO2 = 0,05.22,4 = 1,12 lít
Từ pt (2) => nO2 = \(\frac{3}{2}\)nKClO3 = \(\frac{0,1.3}{2}\) = 0,15 mol
V O2 = 0,15.22,4 = 3,36 lít
c)
Từ pt (1): nKNO3 = 2nO2 = = 0,1 mol
=>mKNO3 = 0,1.101 = 10,1 g
Từ pt (2): nKClO3 = \(\frac{2}{3}\)nO2 = \(\frac{2}{3}\).0,05 mol
V KClO3 = \(\frac{2}{3}\).0,05.122,5 = 4,086 g.
Đúng 0
Bình luận (0)
Từ các hóa chất : KClO3, FeS và dd HCl, với các thiết bị và các chất xúc tác có đủ . Hãy viết các phương trình để điều chế 4 chất khí khác nhau
\(2KClO_3 \xrightarrow{t^o} 2KCl +3O_2\\ KClO_3 +6 HCl \to KCl + 3Cl_2 + 3H_2O\\ FeS + 2HCl \to FeCl_2 + H_2S\\ 4FeS + 7O_2 \xrightarrow{t^o} 2Fe_2O_3 + 4SO_2\)
Đúng 2
Bình luận (0)
Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi tác dụng với sắt ở nhiệt độ cao
a) Viết phương trình hóa học
b) Tính thể tích oxi cần dùng ở(đktc) để điều chế được 2,32g gam oxit sắt từ Fe3O4
a, \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b, \(n_{Fe_2O_3}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
Theo PT: \(n_{O_2}=2n_{Fe_2O_3}=0,02\left(mol\right)\Rightarrow V_{O_2}=0,02.22,4=0,448\left(l\right)\)
Đúng 3
Bình luận (4)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(2mol\) \(1mol\)
\(0,02mol\) \(0,01mol\)
\(n_{Fe_3O_4}=\dfrac{m}{M}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
\(V_{O_2}=n.22,4=0,02.22,4=0,048\left(l\right)\)
Đúng 2
Bình luận (0)
a)\(PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b)\(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(m\right)\)
\(PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
tỉ lệ :3 2 1
số mol :0,03 0,02 0,01
\(V_{O_2}=0,02.22,4=0,448\left(l\right)\)
Đúng 1
Bình luận (0)
C1: trong phòng thí nghiệm, ng ta điều chế oxi bằng cách phân hủy hoàn toàn 15.8g KMnO4 a) Viết Phương trình phản ứng B) tính thể tích oxi điều chế đc(đktc)? C) tính khối lượng sắt cần dùng để phản ứng hết vs thể tích khí oxi thu đc hết ở trên
a) $2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
b) n KMnO4 = 15,8/158 = 0,1(mol)
Theo PTHH : n O2 = 1/2 n KMnO4 = 0,05(mol)
=> V O2 = 0,05.22,4 = 1,12(lít)
c)
$3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$
Theo PTHH : n Fe = 3/2 nO2 = 0,075(mol)
=> m Fe = 0,075.56 = 4,2(gam)
Đúng 2
Bình luận (0)
Theo gt ta có: $n_{KMnO_4}=0,1(mol)$
a, $2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2$
b, Ta có: $n_{O_2}=0,05(mol)\Rightarrow V_{O_2}=1,12(mol)$
c, $3Fe+2O_2\rightarrow Fe_3O_4$
Ta có: $n_{Fe}=0,075(mol)\Rightarrow m_{Fe}=4,2(g)$
Đúng 1
Bình luận (0)
xác định công thức phân tử của CuxOy, biết tỉ lệ khối lượng giữa đồng và oxi trong oxit là 4:1 . viết phương trình phản ứng điều chế đồng và đồng sunfat từ CuxOy (các hóa chất khác tự chọn)
Có: M(Cu) = 64x ; M(O) =16y
=> \(\frac{64x}{16y}=\frac{4}{1}\Rightarrow\frac{x}{y}=1\)
=> Công thức: CuO
Điều chế: CuO + H2 ------> Cu + H2O ( ở nhiệt độ 400oC)
Hoặc: 3CuO +2 Al ---------> Al2O3 + 3Cu
CuO + H2SO4 ---------> CuSO4 + H2O































