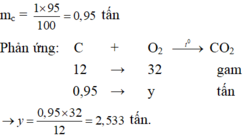đốt cháy 1 kg than có chứa 5% tạp chất không cháy a)tính khối lượng kí cacbonic

Những câu hỏi liên quan
Đốt một mẫu than (chứa tạp chất không cháy) có khối lượng 0,6 kg trong oxi dư thu được 1,06 m 3 (đktc) khí cacbonic. Thành phần phần trăm khối lượng cacbon trong mẫu than trên là
A. 94,64
B. 64,94
C. 49,64
D. 46,94
Đốt cháy 1 kg than trong khí oxi, biết trong than có 5% tạp chất không cháy. Tính thể tích khí cacbonic (đktc) sinh ra trong phản ứng.
Lượng than nguyên chất:
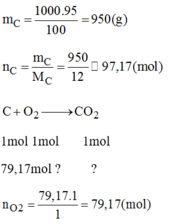
n C O 2 = n O 2 = 79,17(mol) → V C O 2 = V O 2 = 1773,4(l)
Đúng 0
Bình luận (0)
Đốt một mẫu than đá (chứa tạp chất không cháy) có khối lượng 0,600kg trong oxi dư, thu được 1,06 m3 (đktc) khí cacbonic. Tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên.
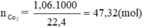
C + O2 → CO2
47,32 ← 47,32 (mol)
Theo pt: nC = nCO2 = 47,32 mol ⇒ mC = 47,32. 12 = 567,84 g
% khối lượng của C là:

Đúng 1
Bình luận (1)
Đốt than (chứa 90% cacbon về khối lượng và tạp chất ko cháy )trong không khí( có Oxi tham gia) tạo ra khí cacbonic
a/ lập PTHH
b/ tính KL than cần dùng biết khối lượng Oxi và Cacbon lần lượt là 3,2kg và 4,4kg
Xem chi tiết
Đốt cháy 1 kg than trong khí oxi , biết trong than có 5 % tạp chất ko cháy.
a) Tính thể tích khí oxi (dktc) cần thiết để đốt cháy 1 kg than trên?
b) Tính thể tich khí cacbonic (dktc) sinh ra trong phản ứng ?
a)
n C = (1000 - 1000.5%)/12 = 475/6 mol
C + O2 --to--> CO2
n O2 = n C = 475/6 mol
=> V O2 = 22,4 . 475/6 = 1773,33(lít)
b) V CO2 = V O2 = 1773,33(lít)
Đúng 2
Bình luận (0)
Đốt một mẫu than đá (chứa tạp chất không cháy) có khối lượng 0,600kg trong oxi dư, thu được 1,06 m3 (đktc) khí cacbonic. Tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên.
C + O2 CO2
1,00mol 1,00mol
47,3 mol = 47,3 (mol)
Phần trăm khối lượng của C trong mẫu than đá: = 94,6%
Đúng 0
Bình luận (0)
Quặng than đá có chứa 3%S và 5% tạp chất không đáy. Tính khối lượng õi cần dùng để đốt cháy 2kg than đá đó
PTHH: \(C+O_2\underrightarrow{t^o}CO_2\)
Ta có: \(m_C=2\cdot92\%=1,84\left(kg\right)\) \(\Rightarrow n_C=\dfrac{1,84}{12}=\dfrac{23}{150}\left(kmol\right)=n_{O_2}\)
\(\Rightarrow m_{O_2}=\dfrac{23}{150}\cdot32\approx4,91\left(kg\right)\)
Đúng 1
Bình luận (0)
Đề có phải thiếu: "Còn lại là Cacbon"
Đúng 0
Bình luận (0)
Tính khối lượng khí oxi cần dùng để đốt cháy hoàn toàn 1 tấn than (chứa 95% cacbon). Những tạp chất còn lại không cháy được.
Tính khối lượng khí oxi cần dùng để đốt cháy hoàn toàn 1 tấn than (chứa 95% cacbon). Những tạp chất còn lại không cháy được.
đốt một mẩu than đá (chứa hợp chất không cháy) có khối lượng 0,6 kg trong oxi dư , thu được 1,06m3 (điều kiện tiêu chuẩn) khí cacbonic . tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên .
C + O2 => CO2
1,06m3 = 1060 (l) => nCO2 = \(\frac{1060}{22,4}=47,32mol\)
nC = nCO2 = 47,32 mol
=> mC = 47,32.12 = 567,84 (g)
m than đá = 0,6kg = 600g
=> % C = \(\frac{567,84}{600}.100\%\) = 94,64%
Đúng 0
Bình luận (0)
C + O2 CO2
1,00mol 1,00mol
47,3 mol = 47,3 (mol)
Phần trăm khối lượng của C trong mẫu than đá: = 94,6%
Đúng 0
Bình luận (0)